根据中国临床研究进展推测,本次该产品申报上市的适应症可能为联合阿扎胞甘一线治疗携带易感IDH1突变的AML患者。
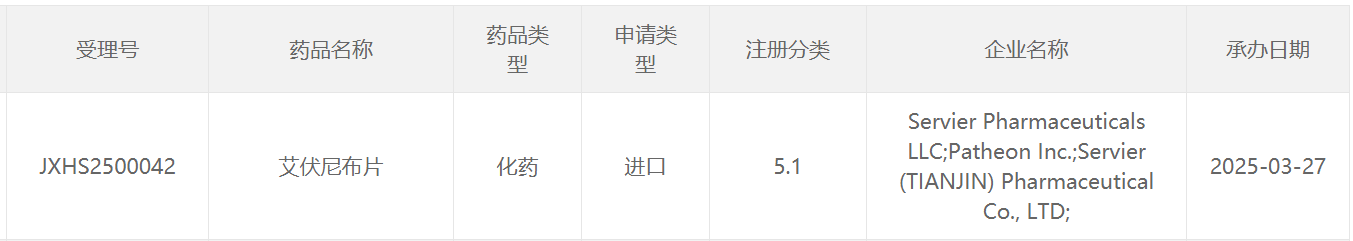 截图来源:CDE官网
截图来源:CDE官网
艾伏尼布片是一种针对IDH1突变酶的口服靶向抑制剂。该产品曾获得美国FDA授予快速通道资格、孤儿药资格,并于2018年7月首次获得FDA批准。在中国,该产品于2020年11月被纳入《第三批临床急需境外新药名单》,于2022年1月通过优先审评审批程序附条件获得中国NMPA批准。2024年8月,该产品还入围了2024年盖伦奖候选名单。
在美国,该药目前已获批适用于经FDA批准的试验检测出的携带易感IDH1突变的患者,包括:与阿扎胞苷联用或单药治疗75岁或以上或有合并症不能使用强化诱导化疗的成人新诊断的AML;单药治疗复发或难治性AML成人患者;治疗复发或难治性骨髓增生异常综合征(MDS)成人患者;既往接受过治疗的局部晚期或转移性胆管癌成年患者。在中国,艾伏尼布已获批准用于治疗携带易感IDH1突变的成年复发性或难治性AML患者。
根据中国药物临床试验登记与信息公示平台官网,研究人员已经在中国开展了一项3期、随机双盲、安慰剂对照的多中心研究,针对受试者人群为IDH1突变急性髓性白血病且未经治疗的患者,评估与联合使用阿扎胞苷和安慰剂相比,联合艾伏尼布片和阿扎胞苷能否显著延长患者总生存期(OS)。该研究在全球20个国家和地区开展,目前已经完成患者招募。
针对一线治疗携带IDH1突变的AML适应症,艾伏尼布片于2022年获得FDA批准。这一批准得到全球性3期临床试验AGILE数据的支持。这是一项全球3期、多中心、双盲、随机、安慰剂对照临床试验,研究结果已在《新英格兰医学杂志》上发表。
试验结果显示,与化疗相比,艾伏尼布与阿扎胞苷联用,显著改善了患者的无事件生存期(EFS)。艾伏尼布与阿扎胞苷联用,显示出总生存期(OS)的统计学显著改善,艾伏尼布组中位OS为24.0个月,是对照组(7.9个月)的3倍。此外,艾伏尼布联合阿扎胞苷的完全缓解(CR)率为47.2%,而安慰剂联合阿扎胞苷为14.9%。艾伏尼布联合阿扎胞苷的完全缓解加完全缓解伴部分血液学恢复的缓解率(CR+CRh)为52.8%,而安慰剂联合阿扎胞苷组为17.6%。艾伏尼布联合阿扎胞苷的客观缓解率(ORR)为62.5%,而安慰剂联合阿扎胞苷组为18.9%。
除了上述适应症,施维雅还在评估艾伏尼布片用于其他IDH1突变癌症的应用潜力。今年1月,施维雅宣布了两项3期临床研究进展更新,两项3期研究分别评估艾伏尼布针对IDH1突变型常规软骨肉瘤、特定的IDH1突变型骨髓增生异常综合征患者的疗效和安全性。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..