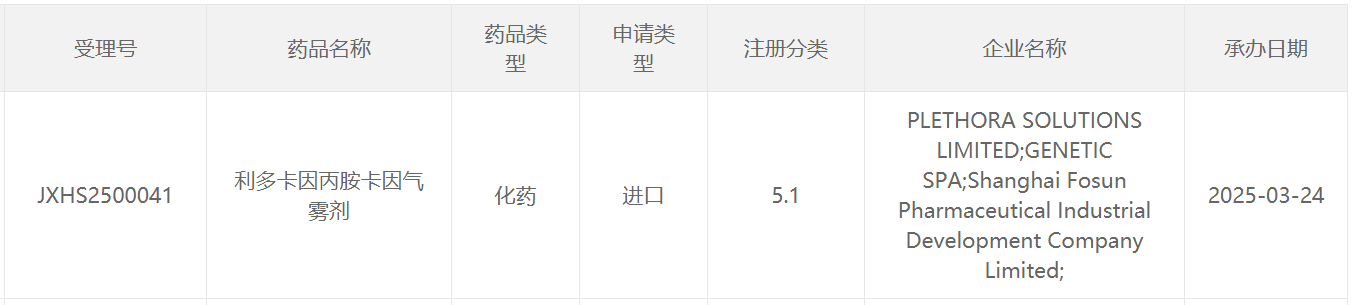
截图来源:CDE官网
根据早先文献报道,中国城市男性中早泄的发生率为2.3%[3],早泄治疗的方法包括心理/行为治疗、局部麻醉药物治疗(如PSD502喷雾)、选择性5 -羟色胺再摄取抑制剂治疗、磷酸二酯酶5型抑制剂治疗等。
据复星医药公开资料介绍,PSD502作为获批用于早泄治疗的药物,在欧洲有近10年的使用经验,其疗效和安全性在3项2期/3期研究中得到验证。PSD502治疗3个月后,早泄患者的阴道内射精潜伏期从基线的0.56分钟提高到2.6分钟,显著改善患者早泄指数中射精控制、性满意度、苦恼各维度的评分。
2023年6月28日,PSD502在中国人群的药代动力学1期研究结果在线发表于Clinical Drug Investigation。该1期研究分别在中国男性及女性健康受试者中评估了局部应用PSD502的耐受性和药代动力学特征。合格的受试者以3:1的比例随机接受PSD502(1次剂量包含3揿,每揿包含7.5mg利多卡因和2.5mg丙胺卡因)或安慰剂治疗。对于男性受试者,除了在第7天和第14天每隔4小时喷洒3揿(共3次9揿)外,每天一次(3揿)在阴茎头喷洒PSD502,持续21天。对于女性受试者,每天1次,于阴道喷洒2揿,宫颈喷洒1揿,连续7天。主要研究终点为PSD502的耐受性和药代动力学特征。
研究表明,接受PSD502的受试者中分别有38.9%男性和66.7%女性发生TEAE(治疗期间出现的不良事件),安慰剂组男性和女性受试者的TEAE发生率都为50%,均为轻中度一过性TEAE,无严重不良事件及导致研究中止的不良事件发生。多次施用后,受试者体内的利多卡因和丙胺卡因快速清除, t1/2约为4h, Cmax均低于预期与全身毒性有关的系统暴露量(5000ng/mL)的1/27。
研究人员认为,该1期研究结果表明在中国男性和女性健康受试者局部施用PSD502,其不良反应可耐受。本项研究的数据发表为PSD502在中国早泄患者中的安全应用提供了循证基础。
根据中国药物临床试验登记与信息公示平台官网,Plethora公司和复星医药已经在中国开展了一项3期临床研究,旨在评价PSD502在中国早泄(PE)受试者中的疗效、安全性和耐受性。该研究目前已经完成。
本次该产品在中国递交上市申请并获得受理,意味着该产品有望在不久的将来惠及患者。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..