本期看点
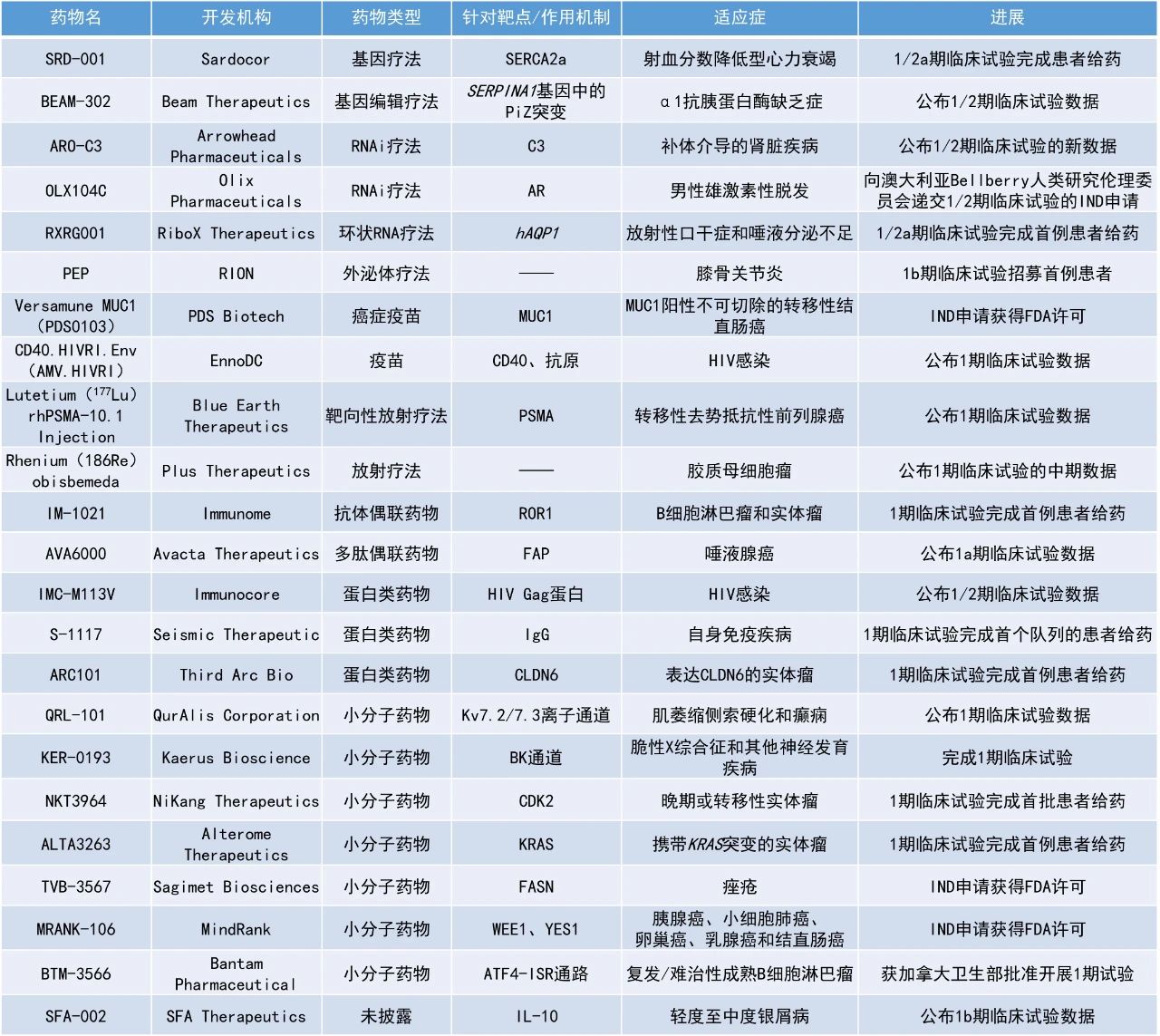
AVA6000:公布1a期临床试验数据
Avacta Therapeutics公司宣布,其在研多肽偶联药物AVA6000在治疗唾液腺癌患者的1a期临床试验中获得积极数据,该公司已开始招募1b期扩展队列,多名患者接受了治疗。唾液腺癌是一种在转移性阶段尚无标准治疗方案的疾病。AVA6000是Avacta研发管线中的首个多肽偶联药物,由阿霉素(doxorubicin)与Avacta专有的pre|CISION多肽偶联而成,该多肽可在肿瘤微环境中由成纤维细胞激活蛋白-α(FAP)特异性切割。FAP在大多数实体瘤中,与健康组织相比表达水平显著升高。Avacta的多肽偶联药物利用这一特征在肿瘤微环境中特异性释放活性药物,从而降低系统暴露和毒性,为患者提供最佳治疗效果。
此次公布的数据显示,与常规治疗患者相比,在接受AVA6000治疗的唾液腺癌患者中观察到令人鼓舞的PFS数据。在接受250 mg/m²及以上剂量治疗的11名唾液腺癌患者中,DCR达91%,5名患者肿瘤显著缩小,其中包括1例部分缓解(PR,肿瘤缩小超过30%)和4例轻微缓解(MR,肿瘤缩小10%-29%)。中位随访时间约为5个月,尚未达到中位PFS,而先前研究中使用常规抗癌治疗患者的中位PFS约为3.5个月。安全性方面,AVA6000的耐受性良好,没有观察到与常规剂量阿霉素相关的严重心脏毒性事件。
Rhenium(186Re)obisbemeda:公布1期临床试验的中期数据
Plus Therapeutics公司宣布,其主打放射治疗药物Rhenium(186Re)obisbemeda治疗胶质母细胞瘤的1期临床试验结果已发表在Nature Communications上。该疗法是一款新型可注射放疗药物,专门配制用于以安全、有效和方便的方式在中枢神经系统(CNS)肿瘤中递送专一靶向的高剂量辐射,以优化患者临床结局。由于186Re的半衰期短,具有破坏癌组织的β放射能和可用于活体成像的γ放射能,是CNS治疗应用的理想放射性同位素。
此次公布的结果显示,21名患者的中位OS为11个月,12名接受超过100 Gy辐射剂量的患者的中位OS为17个月,是接受标准治疗的复发性GBM患者的中位OS(约8个月)的两倍多。安全性方面,未观察到剂量限制性毒性,且大多数不良事件与研究治疗无关。
BEAM-302:公布1/2期临床试验数据
Beam Therapeutics公布了在研单碱基编辑疗法BEAM-302用于治疗α1抗胰蛋白酶缺乏症(AATD)患者的1/2期临床试验结果。BEAM-302是一种针对肝脏的脂质纳米颗粒(LNP)配方,内含指导RNA(gRNA)和编码碱基编辑器的mRNA,旨在修正致病的PiZ突变。新闻稿指出,这是首个利用碱基编辑疗法,在体内纠正致病基因突变的临床试验结果,代表着体内碱基编辑疗法的临床概念验证。
此次公布的结果显示,在单次输注BEAM-302后,观察到血液循环中总α-1抗胰蛋白酶(AAT)迅速、持久且呈剂量依赖性增加,新产生的具有治疗水平的修正蛋白AAT,以及突变型AAT的减少。在接受治疗后第7天便观察到总AAT的变化,第21天左右达到平台期,并在随访期间持续存在。中性粒细胞弹性蛋白酶抑制及结合检测均证实,增加的AAT具有功能性。在迄今探索的所有剂量水平下,BEAM-302治疗均显示出良好的耐受性和可接受的安全性。
IMC-M113V:公布1/2期临床试验数据
Immunocore公司公布了其在研疗法IMC-M113V治疗HIV感染者的1/2期临床试验的初步数据。IMC-M113V利用一种T细胞受体与HIV感染免疫细胞上的HLA-A*02:01-Gag复合物结合。该分子的抗CD3效应臂随后招募T细胞摧毁含有整合HIV DNA的CD4阳性细胞,消灭所谓的病毒储存库。
数据显示,IMC-M113V耐受性良好,并在中断抗逆转录病毒治疗(ART)后呈现剂量依赖性控制病毒的迹象。在15名可评估的HIV感染者中,120微克队列中1人、300微克队列中2人在分析性ART治疗中断(ATI)期间观察到延迟病毒反弹的情况。这3名显示病毒控制的患者在第8周的病毒载量约为200 c/mL。此外,这3名患者中有2人在预先规定的12周ATI期间始终未接受ART治疗。该试验的多次递增剂量(MAD)部分仍在进行中,正在评估更高剂量,随后还将设立一个或多个剂量的扩展队列。
QRL-101:公布1期临床试验数据
QurAlis Corporation公司宣布,其QRL-101的1期机制验证(PoM)临床试验在健康受试者中取得了积极的顶线数据,该试验旨在评估与肌萎缩侧索硬化(ALS)和癫痫相关的生物标志物。QRL-101是一种潜在“best-in-class”的选择性Kv7.2/7.3离子通道开放剂,用于治疗ALS患者由于过度兴奋引起的疾病进展,这种现象在散发性和遗传性ALS中均有发生,多数由KCNQ2基因mRNA前体的错误剪接引起。Kv7通道也是经临床验证的调节癫痫过度兴奋状态的有效靶点。体内和体外研究表明,与选择性较差的第一代Kv7.2/7.3通道开放剂ezogabine相比,QRL-101显示出更高的效力,并可能引发更少的临床不良事件。
此次公布的结果显示,QRL-101在ALS相关的主要终点——运动神经兴奋性阈值追踪(mNETT)强度-时间常数(SDTC)上表现出剂量依赖性的显著降低,降幅比第一代Kv7.2/7.3通道开放剂在ALS患者中的单剂量研究结果高出约50%。此外,QRL-101对癫痫相关的多个次要和探索性终点也显示出显著影响,表明其能有效透过血脑屏障并具有潜在的抗癫痫作用。安全性方面,QRL-101的安全性和耐受性与其之前的研究结果一致,未报告严重不良事件或因不良事件导致的停药。
RXRG001:1/2a期临床试验完成首例患者给药
转录本生物科技有限公司(RiboX Therapeutics,简称RiboX)宣布,RXRG001用于治疗辐射诱导的口干症和唾液分泌不足的1/2a期临床试验已完成首例患者给药。RXRG001是RiboX自主研发的由LNP包裹的环形RNA药物,通过LNP递送环形RNA在唾液腺中表达水通道蛋白AQP1增强透水性,从而提高进入口腔中的唾液流量及流速,改善患者口干症状。临床前研究显示,RXRG001展现了持久疗效同时具备良好的耐受性和安全性。单次给药后可显著增加唾液流量,并且效果可持续长达四周。新闻稿指出,RXRG001是全球首个获FDA许可进入临床试验的环形RNA疗法。
TVB-3567:IND申请获得FDA许可
Sagimet Biosciences公司宣布,其用于治疗痤疮的脂肪酸合成酶(FASN)抑制剂TVB-3567的IND申请已获得批准。TVB-3567是一种强效的选择性小分子FASN抑制剂,计划于2025年开始首次人体1期临床试验。痤疮的发生与皮肤中皮脂分泌增加密切相关。FASN是从头脂肪生成途径中的最后一步,该途径产生约80%的皮脂脂质。先前的临床前和临床研究表明,FASN抑制剂可以改善皮脂成分并显著减少痤疮病变,有潜力作为治疗痤疮的靶点。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..