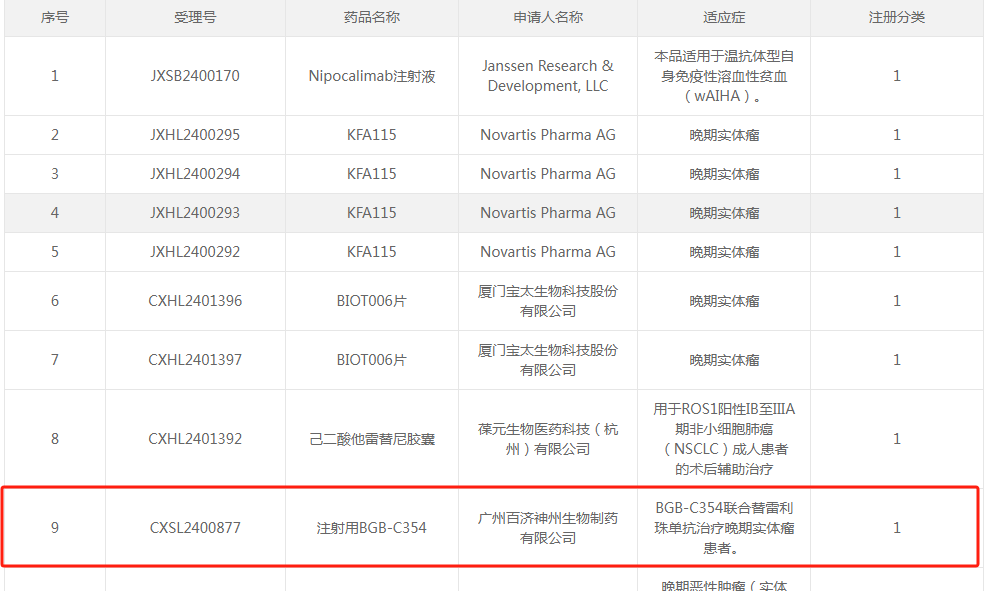
2025年3月4日,CDE官网显示,百济神州申报的1类新药注射用BGB-C354获得一项新的临床试验默示许可,拟联合替雷利珠单抗治疗晚期实体瘤患者。据悉,BGB-C354是百济神州一款靶向B7H3(又称CD276)的ADC产品,通过抗体精准识别肿瘤细胞表面的B7H3蛋白(在肺癌、乳腺癌等高发实体瘤中过度表达),定向释放细胞毒性药物,显著降低对正常组织的损伤。目前该药处于临床I期阶段,最初于2024年9月获批IND,此次获批适应症为联合替雷利珠单抗治疗晚期实体瘤,预计2025年下半年将取得BGB-C354的内部概念验证数据。目前来看,百济神州的ADC共有四条,均处于临床I期阶段。除靶向B7H3的ADC外,还布局三款差异化布局的ADC产品,分别是靶向FGFR2的BG-C137、靶向CEACAM5的BG-C477、靶向VTCN1的BG-C9074,适应症清一色的实体瘤方向。百济神州开发的一款FGFR2b ADC(抗体药物偶联物)。这种药物主要用于治疗晚期实体瘤,其作用机制是针对纤维母细胞生长因子受体2b(FGFR2b)进行靶向治疗。2024年10月12日首次提交临床申请,FGFR2b是胃和皮肤等上皮细胞中的FGF受体形式,约30%的HER2阴性胃食管癌患者中存在其过度表达,阻断其激活或能减缓癌症发展。据摩熵医药数据库,2024年以来,百济神州已有超12款1类新药在国内首次获批进入临床,涵盖双抗、三抗、ADC及小分子新药等类型,其中11款为抗肿瘤新药。2024年12月19日,BG-C137获批临床。作为一款靶向癌胚抗原(CEA)的ADC候选药物,CEA是一种糖蛋白,在多种类型的癌细胞中广泛表达,并在细胞迁移、侵袭和黏附中起关键作用。CEA几乎不在其他正常细胞中表达,是实体肿瘤治疗的理想靶点。作为CEA调节剂,该药物设计原理基于一旦与癌细胞表面的CEA结合,整个ADC复合物就会被细胞内化,随后释放细胞毒性药物杀死癌细胞。资料介绍,百济神州的该款ADC的设计,采用新型拓扑异构酶抑制剂作为Payload,DAR值可达8,临床前研究中表现出优于SAR701的抗肿瘤活性。该产品具有差异化ADC设计以提升CEA阳性肺癌和胃肠道癌患者疗效,也可在中低表达患者中实现广泛靶向。该款ADC是一款靶向B7H4的抗体偶联药物(ADC)。是百济神州于2023年7月从映恩生物引进的一款ADC产品(全球开发和商业化权利)。B7H4作为最新发现的B7家族成员之一,为一种在多种肿瘤中过度表达的细胞表面蛋白,可帮助肿瘤细胞逃避免疫系统的监测。研究表明,B7H4在三阴性乳腺癌(74%)、卵巢癌(77%)、子宫内膜癌(94%)和胆管癌(89%)中最常见,而在正常组织中的表达有限。此外,B7H4独立于PD-L1表达,通常在PD-L1阴性肿瘤中高表达,展示出区别于PD-1/L1的另一种免疫逃逸机制。这表明针对B7H4通路的疗法有望对PD-L1阴性/难治性患者发挥作用。2024年7月30日,百济神州在药物临床试验登记与信息公示平台网站上注册了BG-C9074单药治疗及其与替雷利珠单抗联合用药治疗晚期实体瘤患者的1a/1b期首次人体研究。很明显,相比绝大多数Biotech企业就ADC的同质化布局,百济神州毅然选择B7H3等竞争较少的靶点,并聚焦实体瘤领域,并试图与自身PD-1等管线形成联用潜力。这种“靶点差异化+技术改良+全球协同”的布局也正是其核心竞争所在,但无论如何,企业的长期成功依赖数据较多,对于百济神州在ADC能否取得成功,或许还要考虑后期临床数据的验证、商业化效率的提升以及对新兴技术趋势的快速响应能力。