3 月4日,CDE 官网显示,Horizon 和翰森制药联合申报的伊奈利珠单抗注射液新适应症上市申请获受理。
根据临床试验进展,Insight 数据库推测用于治疗免疫球蛋白 G4 相关性疾病(IgG4-RD)。这是国内首个寻求 IgG4-RD 监管批准的产品。
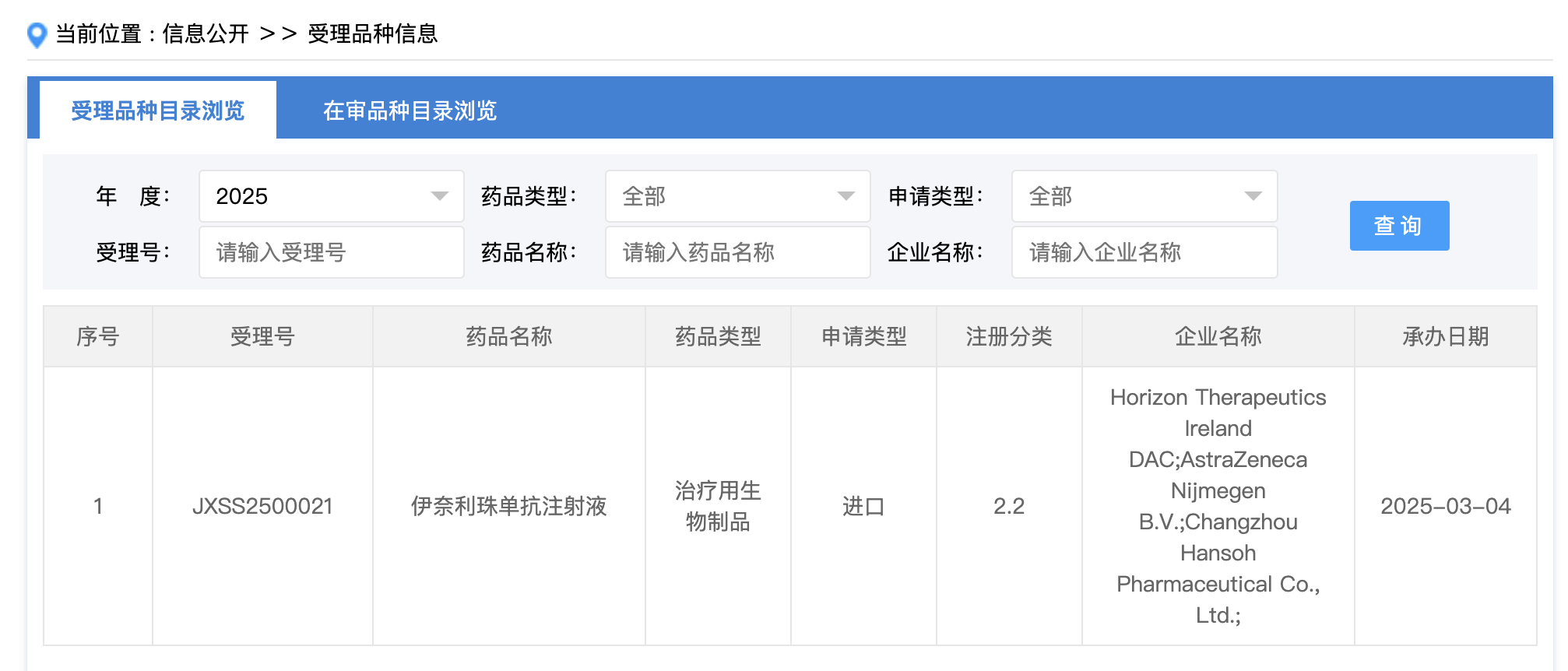
来源:CDE 官网
此前 2 月,伊奈利珠单抗 IgG4-RD 适应症已获国家药监局纳入优先审评审批程序。2024 年 8 月,美国 FDA 授予伊奈利珠单抗用于 IgG4 相关性疾病的突破性疗法认定,目前相关监管手续正在申报中。
此次上市申请主要基于全球关键性 III 期试验 MITIGATE 的积极结果。MITIGATE 在包括中国在内的 22 个国家的 80 个临床试验研究中心进行。
这是首次在IgG4相关性疾病中进行的随机、双盲、安慰剂对照研究,证实了伊奈利珠单抗通过 CD19+B 细胞耗竭治疗 IgG4-RD 的安全性和有效性。具体结果显示:
验证伊奈利珠单抗的独特作用机制,能够快速并持续地耗竭外周 B 细胞的数量,从而降低疾病生物标志物的水平。
2020 年 6 月,伊奈利珠单抗获 FDA 批准上市,用于治疗 AQP4 抗体阳性的视神经脊髓炎谱系障碍(NMOSD)。2022 年 3 月,该产品在中国获批用于治疗 NMOSD。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..