2月12日,中国国家药监局药品审评中心(CDE)官网最新公示显示,诺和诺德(Novo Nordisk)申报的3.1类新药司美格鲁肽注射液新适应症上市申请获得受理,尚无具体适应症信息披露。根据注册分类及诺和诺德公开资料推测,这可能是司美格鲁肽2.4mg注射剂(商品名为Wegovy),此前已经在中国获批用于长期体重管理。本次该产品在中国申报上市的适应症可能为用于低已确诊心血管疾病的肥胖或超重成人的主要不良心血管事件(MACE)风险。
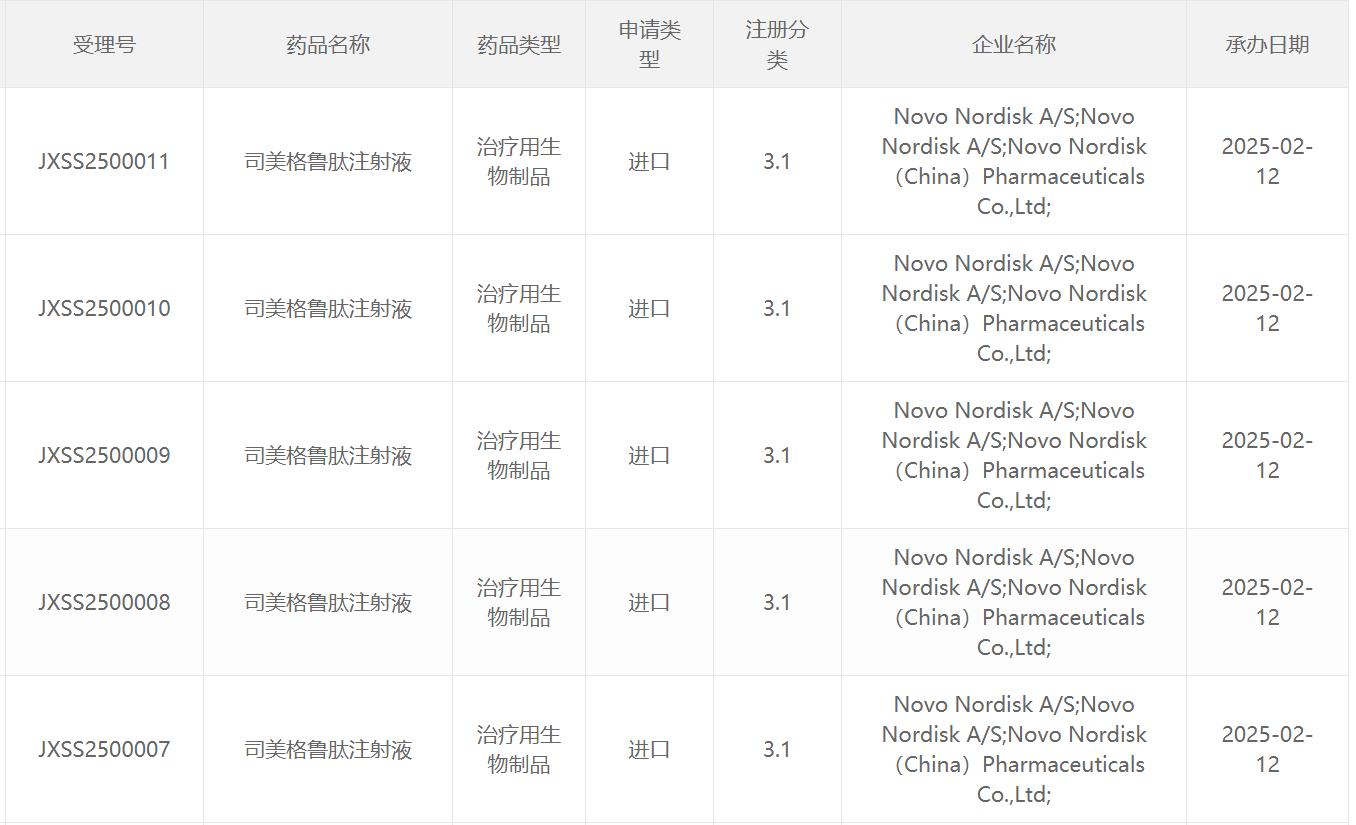
截图来源:CDE官网
司美格鲁肽是一种长效GLP-1类似物,它与天然GLP-1的氨基酸序列具有94%的同源性,能起到GLP-1受体激动剂的作用。
司美格鲁肽注射液(Wegovy,2.4 mg)于2021年6月最早获美国FDA批准用于治疗普通肥胖患者,于2024年6月在中国获批用于长期体重管理。2024年3月,Wegovy再次获FDA批准,用于在超重或肥胖且已确诊心血管疾病(CVD)的成人患者中降低主要不良心血管事件(MACE)的风险。此项批准基于SELECT心血管结局试验,该研究在5年时间内评估司美格鲁肽2.4mg和安慰剂结合标准治疗在超重或肥胖且已确诊CVD但无糖尿病病史的人群中预防MACE的疗效。研究的主要目标是证实与安慰剂相比,司美格鲁肽2.4mg在降低3点MACE(包括心血管死亡、非致死性心脏病发作[心肌梗死]或非致死性卒中)发病率方面的优效性。
SELECT研究数据此前已经发表于《新英格兰医学杂志》(NEJM)。该试验表明:结合标准治疗,Wegovy相较于安慰剂实现了20%的MACE风险降低,具有统计学意义。SELECT研究结果还表明:在长达5年的时间内,无论受试者基线年龄、性别、种族、民族、体质指数(BMI)和肾功能损害程度,均实现了MACE风险降低。
在全球范围内,司美格鲁肽注射液0.25、0.5和1.0mg(商品名为Ozempic)也已经获美国FDA批准三项适应症,分别用于:治疗成人2型糖尿病;降低患有已知心脏病的成人2型糖尿病患者的主要心血管事件风险;降低肾脏疾病恶化、肾衰竭(终末期肾脏疾病)和心血管疾病导致的成人2型糖尿病和慢性肾脏疾病死亡的风险。
在中国,Ozempic已经获NMPA批准用于治疗成人2型糖尿病患者,以及用于降低伴有心血管疾病的2型糖尿病成人患者的主要心血管不良事件风险。此外,2024年8月,诺和诺德以生物制品2.2类申报的司美格鲁肽注射液新适应症上市申请也获得NMPA受理,根据注册分类可知该项适应症为针对糖尿病肾病。
除了上述已在全球范围内获批的适应症,司美格鲁肽注射液还已经在多种适应症方面取得新的进展,包括:
2024年11月,诺和诺德公布了3期ESSENCE试验第一部分的最新研究结果。分析显示,试验达成了双主要终点,与安慰剂相比,2.4 mg剂量的司美格鲁肽注射液可显著改善代谢功能障碍相关脂肪性肝炎(MASH)患者的肝纤维化,同时未加重脂肪性肝炎。62.9%实现了脂肪性肝炎缓解且肝纤维化无恶化,而安慰剂组在此数值上为34.1%。
2024年11月,诺和诺德宣布Ozempic用于治疗患有外周动脉疾病(PAD)的2型糖尿病患者的3b期试验达到主要终点。在试验52周时,司美格鲁肽与安慰剂相比患者在最大步行距离上显著提升达13%,该结果具有临床意义。根据此积极结果,诺和诺德预计将于2025年上半年在美国和欧盟递交Ozempic扩展适应症的监管申请。
2024年10月,一篇发布于知名期刊Alzheimer's & Dementia的研究指出,与其他糖尿病药物相比,Ozempic与2型糖尿病(T2DM)患者确诊为阿尔茨海默病(AD)风险降低40%-70%相关。这一发现支持Ozempic在神经退行性疾病中的进一步研究。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..