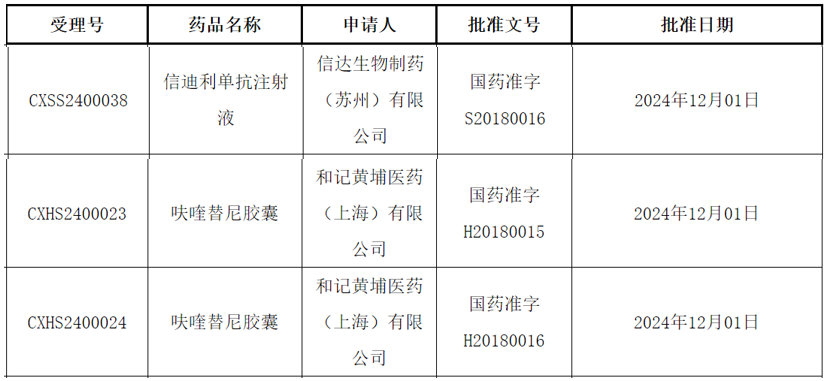
12月3日,中国国家药监局(NMPA)官网公示,信达生物PD-1抑制剂信迪利单抗与和黄医药VEGFR抑制剂呋喹替尼的联合疗法上市申请已获得批准。根据NMPA药品审评中心(CDE)优先审评公示,该联合疗法获批的适应症为:既往系统性抗肿瘤治疗后疾病进展且不适合进行根治性手术治疗或根治性放疗的晚期错配修复完整(pMMR)或非微卫星高度不稳定(非MSI-H)的子宫内膜癌。子宫内膜癌是一种始于子宫的癌症。尽管早期子宫内膜癌可以通过手术切除,但复发性和/或转移性子宫内膜癌领域仍然存在巨大未满足的需求,患者的治疗结果不佳且治疗选择有限。信迪利单抗是一种人类免疫球蛋白G4(IgG4)单克隆抗体,能特异性结合T细胞表面的PD-1分子,从而阻断导致肿瘤免疫耐受的PD-L1通路,重新激活淋巴细胞的抗肿瘤活性,从而达到治疗肿瘤的目的。呋喹替尼是一种高选择性、强效的口服VEGFR-1、-2及-3抑制剂。呋喹替尼的独特设计使其激酶选择性更高,以达到更低的脱靶毒性、更高的耐受性及对靶点更稳定的覆盖。科学研究表明,PD-1单抗与VEGFR抑制剂联合使用将有明显的协同效应。2018年11月,信达生物与和黄医药宣布合作开展信迪利单抗与呋喹替尼用于实体瘤联合治疗的临床评估。根据和黄医药此前新闻稿介绍,FRUSICA-1研究的数据支持了此项联合疗法的新药上市申请。FRUSICA-1是一项多中心、开放标签的2期临床试验的子宫内膜癌注册队列,旨在评估呋喹替尼联合信迪利单抗治疗含铂双药化疗治疗后疾病复发、疾病进展或出现不可耐受的毒性的子宫内膜癌患者。研究的主要终点是独立审查委员会 (IRC) 评估的客观缓解率 (ORR),次要终点包括疾病控制率 (DCR)、缓解持续时间 (DoR)、无进展生存期 (PFS)、总生存期 (OS) 和药代动力学评估。试验结果表明,无论患者既往是否接受过贝伐珠单抗 (bevacizumab) 治疗,该联合疗法均展现出具有意义的疗效改善及可控的毒性特征。