1. Cue Biopharma公司公布了其两款新型生物制品的积极临床数据,其中接受CUE-101联用PD-1抑制剂pembrolizumab一线治疗的HPV阳性复发性/转移性头颈部鳞状细胞癌(R/M HNSCC)患者12个月时的总生存率为91.3%。
2. 胸苷酸合成酶抑制剂NUC-3373联用pembrolizumab在一项临床研究中使1名尿路上皮膀胱癌患者的靶病灶缩小了100%。
3. 用于治疗慢性乙肝病毒(HBV)感染的表观遗传沉默剂TUNE-401在新西兰获批进入1b期临床试验。
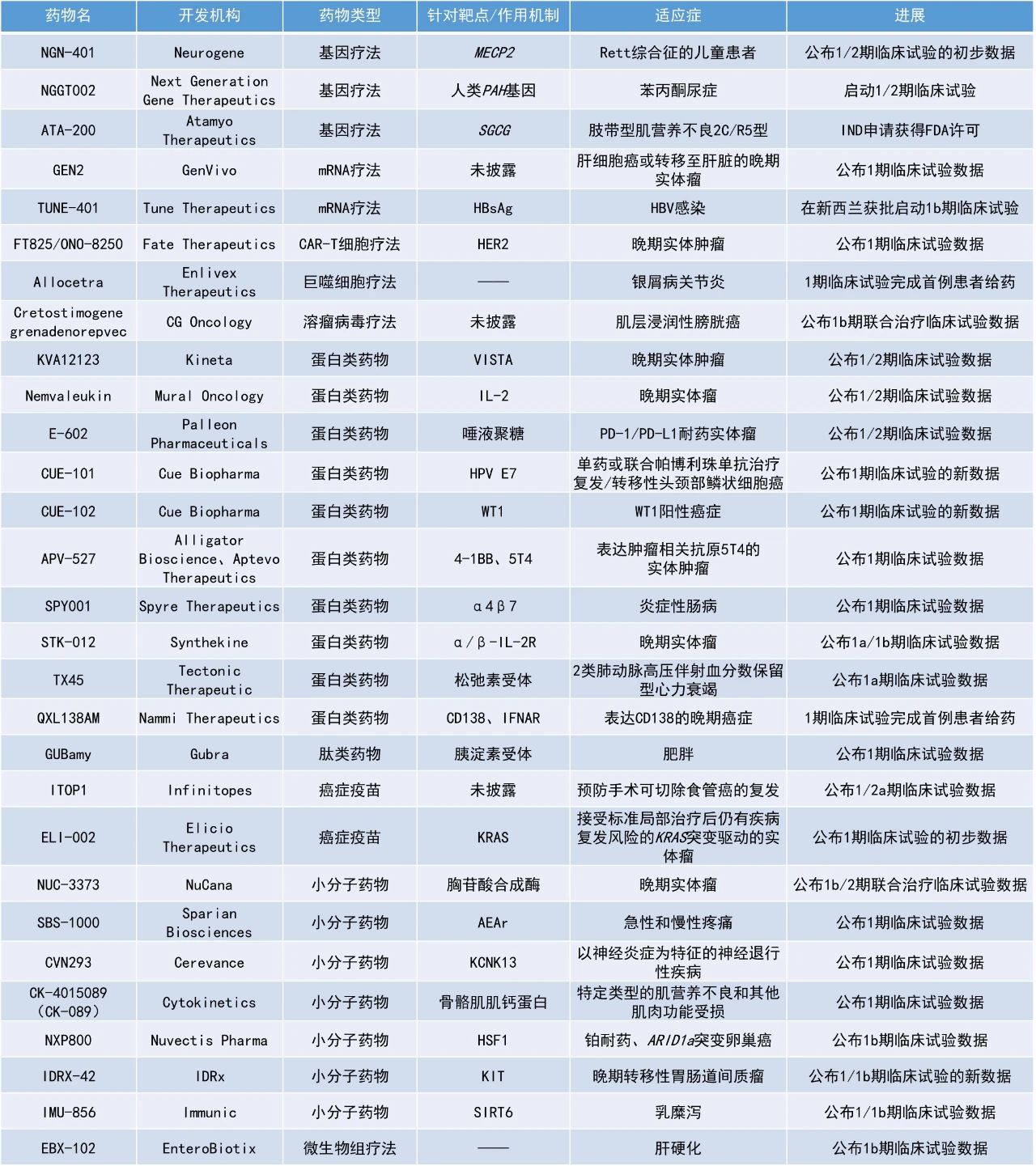
CUE-101、CUE-102:公布1期临床试验的新数据Cue Biopharma公司公布其CUE-101治疗头颈癌和CUE-102治疗WT1阳性癌症的1期临床试验的积极新数据。CUE-101是该公司开发的一款基于白细胞介素-2(IL-2)的T细胞诱导剂,旨在选择性调节和激活HPV阳性T细胞,以提高疗效,同时减少传统免疫疗法的副作用。CUE-102是一种由两个呈递WT1肽的人白细胞抗原(HLA)分子、四个亲和力减弱的IL-2分子和一个效应减弱的人免疫球蛋白G(IgG1)Fc结构域组成的新型生物制品,被开发作为单一疗法治疗WT1阳性复发/转移性癌症患者。截至2024年9月11日的数据,接受CUE-101联用PD-1抑制剂pembrolizumab一线治疗的HPV阳性R/M HNSCC患者的客观缓解率(ORR)为46%,疾病控制率(DCR)为75%,12个月时的总生存率为91.3%,中位总生存期(OS)为21.8个月。在历史研究KEYNOTE-048中,pembrolizumab单药治疗的ORR为19%,12个月时的总生存率为51%,中位OS为12.3个月。在本研究中,1例患者达到完全缓解(CR),10例患者达到部分缓解(PR),以及7例患者获得了超过12周的持久疾病稳定(SD)。接受该一线联合治疗的PD-L1低表达患者的ORR为50%。截至2024年10月29日的数据,接受CUE-102单药治疗的晚期胰腺癌患者的DCR为67%,其中包括肿瘤负荷减少40%的未确认的PR。有证据表明,WT1特异性CD8阳性T细胞受到了选择性刺激和扩增,而非特异性CD8阳性T细胞的总数没有明显增加。NUC-3373:公布1b/2期联合治疗临床试验数据NuCana公司公布了其正在进行的1b/2期模块化研究的初步数据,模块1研究评估了NUC-3373联用PD-1抑制剂pembrolizumab治疗晚期实体瘤患者的疗效,模块2研究评估了NUC-3373联用多西他赛治疗肺癌患者的疗效。NUC-3373是一种胸苷酸合成酶抑制剂,由核苷类似物5-氟尿嘧啶衍生而来,可导致DNA损伤。模块1包括12名患有各种实体瘤、已用尽所有其他治疗方案的患者,其中9例患者曾接受过PD-1/PD-L1抑制剂的治疗。接受NUC-3373联用pembrolizumab治疗后,患者实现了显著的肿瘤体积缩小,PFS得到延长。2名患者获得了确认的PR,4例患者达到SD。在疗效可评估人群中,ORR为22%,DCR为67%。其中,1例尿路上皮膀胱癌患者接受联合治疗后靶病灶缩小了100%(非靶病灶依然存在),1例BRAF突变转移性皮肤黑色素瘤患者的靶病灶缩小了81%。此外,NUC-3373联合pembrolizumab的耐受性普遍良好。模块2包括4名非小细胞肺癌(NSCLC)或胸膜间皮瘤患者,这些患者在既往含化疗方案中出现疾病进展或无法耐受。患者在接受NUC-3373联用多西他赛治疗后PFS得到延长,2例患者实现了长期的SD。Tune Therapeutics公司宣布,该公司已获得新西兰药品和医疗器械安全局(Medsafe)的临床试验申请(CTA)批准,将推进其用于治疗慢性HBV感染的表观遗传沉默剂TUNE-401进入1b期临床试验。TUNE-401是一款潜在"first-in-class"的表观遗传沉默剂,利用Tune Therapeutics的多功能、模块化TEMPO平台所开发。TUNE-401通过脂质纳米颗粒(LNP)将编码活性、HBV靶向的RNA直接递送至肝细胞。在这些细胞内,所递送的RNA被翻译为表观沉默蛋白,靶向整合入宿主细胞的乙肝病毒DNA(intDNA)和共价闭合环状DNA(cccDNA)。cccDNA是一种独特、游离的环状染色体(episomes),可作为病毒进行复制时的模板,是造成HBV患者多年持续感染的原因之一。临床医生认为,关闭这些cccDNA“病毒工厂”是实现HBV功能性治愈的必要前提。TUNE-401不涉及切割或编辑DNA,其导致产生的活性表观沉默蛋白通过添加甲基基团与DNA结合,以抑制或失活病毒基因,同时保持人类基因的完整性。根据新闻稿,TUNE-401是首个获批进入临床,用以治疗常见传染病的表观遗传疗法。Kineta公司公布了其正在进行的1/2期临床试验的最新进展,该试验评估了其新型在研VISTA阻断免疫疗法KVA12123单药或与PD-1抑制剂pembrolizumab联用在晚期实体瘤患者中的治疗效果。KVA12123是一种单克隆抗体疗法,需每周输注两次。通过将独特的表位与优化的IgG1 Fc区相结合,KVA12123单药在临床前模型中显示出强大的肿瘤生长抑制作用,且在临床试验中没有报告细胞因子释放综合征(CRS)。KVA12123已被证明能降低VISTA靶点的风险,并提供了一种新的方法来解决肿瘤微环境中的免疫抑制问题,其作用机制与以T细胞为重点的疗法不同且互补。截至2024年10月18日的数据,接受KVA12123单药治疗并至少进行了一次随访扫描的19例患者中,有13名实现了SD。在许多接受KVA12123单药治疗的患者中观察到持久的临床结果,其中1名此前已接受过六线治疗(包括免疫检查点抑制剂治疗)的NSCLC患者已保持SD状态60周。在接受KVA12123联合pembrolizumab治疗并至少进行了一次随访扫描的9例患者中,1例粘液表皮样癌患者获得了PR,靶病灶缩小了54%,非靶病灶获得了CR;1名免疫检查点抑制剂治疗后进展的肾细胞癌患者达到SD,靶病灶缩小了24%。安全性方面,KVA12123的耐受性良好,单药或与pembrolizumab联用在任何剂量水平上都未出现剂量限制性毒性(DLT)。IDRx公司公布了其用于治疗晚期胃肠道间质瘤(GIST)的在研口服小分子KIT酪氨酸激酶抑制剂IDRX-42的1/1b期临床试验数据。IDRX-42旨在选择性地靶向最常见的KIT突变形式,这些突变要么驱动肿瘤细胞的初始生长、增殖和生存,要么使肿瘤对现有疗法产生耐药性。截至2024年9月30日的数据,87例中位治疗线数为四线、疗效可评估患者的ORR为29%,包括1例CR和24例PR。接受IDRX-42作为二线治疗患者的ORR为53%(8/15),包括1例CR和7例PR,这些患者的中位PFS尚未达到。接受IDRX-42作为三线治疗的患者的中位PFS估计为12.9个月。既往未使用过ripretinib、接受IDRX-42作为≥四线治疗的患者在推荐的1b期剂量下,其中位PFS估计为11.0个月。此外,IDRX-42具有良好的安全性,在推荐的1b期剂量下,8%的患者减少了剂量,没有因治疗伴发不良事件而停药的情况。Alligator Bioscience公司和Aptevo Therapeutics公司公布了APV-527用于治疗可能表达肿瘤抗原5T4实体瘤患者的1期临床试验数据。APV-527是一种靶向4-1BB和肿瘤抗原5T4的双特异性抗体,仅在与4-1BB和5T4同时结合时才有活性。此次公布的结果显示,16例疗效可评估的患者中有9例(56%)达到SD,其中,1例结肠癌患者已保持SD超过6个月。最长的SD持续时间发生在一名乳腺癌患者中,该患者进入研究时病情发生进展,目前病情保持稳定,且已参与研究超过11个月。安全性方面,APV-527在所有队列中均表现出积极的安全性和耐受性,尚未观察到严重的肝毒性。肝毒性是其他4-1BB靶向治疗的常见副作用,可导致患者停药。Elicio Therapeutics公司公布了其在研治疗性癌症免疫疗法ELI-002用于治疗接受标准局部治疗后仍有疾病复发风险的KRAS突变驱动实体瘤的1期临床试验的初步结果。ELI-002由AMP修饰的KRAS突变体(mKRAS)肽段,和一种AMP修饰的免疫刺激寡核苷酸佐剂ELI-004组成,经皮下给药靶向淋巴结。它能产生RAS特异性杀伤性T细胞,以攻击术后残留肿瘤细胞,有望延长癌症患者缓解并可预防未来复发。初步数据表明,靶向KRAS突变体的T细胞反应持久且呈剂量依赖性,并诱导了针对患者特异性新抗原的反应。观察到无病生存期(DFS)与T细胞反应强度之间存在相关性。此外,ELI-002的1期安全性及耐受性特征依然良好,未观察到DLT或CRS。Gubra公司公布了长效胰淀素(amylin)类似物GUBamy在单剂量递增(SAD)1期临床试验中获得的积极结果。GUBamy耐受性良好,表现出良好的药代动力学特征,半衰期为11天,支持每周一次的给药方案。此外,单剂量的GUBamy剂量依赖性地降低体重,这一效果在试验期间(6周)内持续存在。在所有高剂量组(3.5-6.0 mg)中,受试者在6周试验期内的平均体重下降约3%,而安慰剂组的体重平均增长约1%。
