来源:CDE官网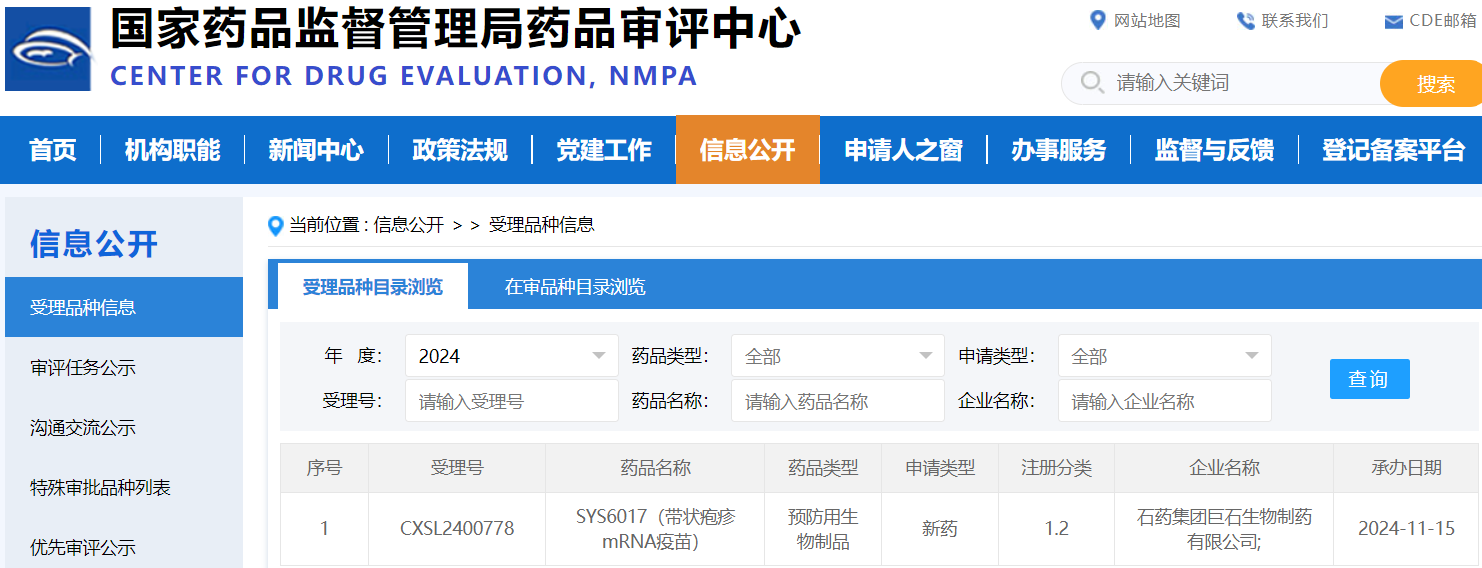
2024年11月12日,石药集团发布公告,集团开发的针对人乳头瘤病毒(HPV)16或18型所引起的相关癌前病变的治疗性二价信使RNA(mRNA)疫苗SYS6026已获中华人民共和国国家药品监督管理局批准,可以在中国开展临床试验。
2024年10月25日,石药集团宣布,本集团开发的首款基于mRNA-LNP的嵌合抗原受体(CAR)-T细胞注射液(SYS6020)已获中华人民共和国国家药品监督管理局批准,可以在中国开展重症肌无力(MG)适应症的临床试验。此前,该产品已经获得多发性骨髓瘤(MM)以及系统性红斑狼疮(SLE)的临床试验批准。
2024年7月11日,石药集团宣布,本集团开发的呼吸道合胞病毒(RSV)mRNA疫苗(SYS6016)已获得中华人民共和国国家药品监督管理局批准,可以在中国开展临床试验。 SYS6016由编码呼吸道合胞病毒全长融合糖蛋白(F蛋白)融合前构象的mRNA分子包裹于脂质纳米颗粒所构成,适用于预防由RSV感染引起的下呼吸道疾病。临床前研究显示,该产品在体内翻译为融合前构象F蛋白并诱导高滴度且持久的中和抗体,对RSV-A和RSV-B亚型病毒株均具有较好的保护作用,且具有良好的安全性。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..