中国药物临床试验登记与信息公示平台官网近日公示,武田(Takeda)在中国启动了两项TAK-861的国际多中心3期临床研究,分别为一项评价TAK-861治疗发作性睡病伴猝倒的疗效和安全性的研究,以及一项在患有选定中枢性睡眠过度疾病的受试者中开展的评价TAK-861长期安全性和耐受性的研究。
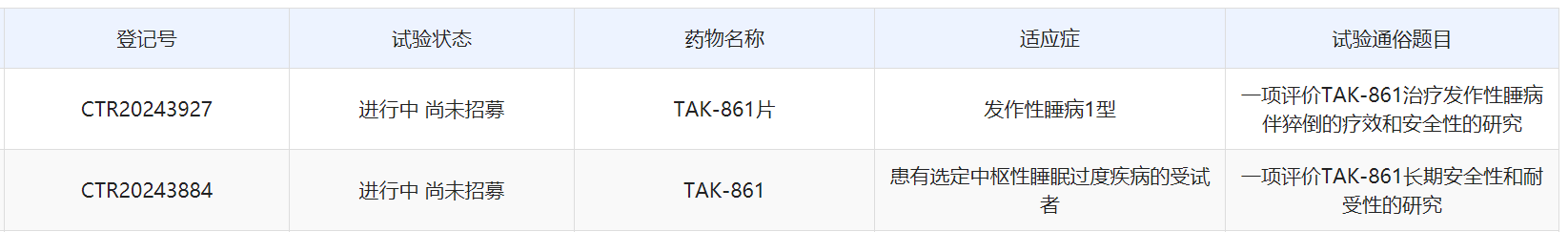
截图来源:中国药物临床试验登记与信息公示平台官网
NT1是一种慢性、罕见的中枢神经系统过度嗜睡障碍,患者由于食欲素(orexin)神经元的大量丧失,导致大脑和脑脊液中食欲素神经肽水平低下,由此会出现日间过度思睡(EDS)、猝倒、夜间睡眠中断、入睡和醒来时的幻觉等症状。这些衰弱症状显著降低生活质量,并严重影响患者工作、生活和人际关系。
食欲素是睡眠-觉醒周期的关键调节器,并参与呼吸和新陈代谢等其他基本功能。TAK-861是武田食欲素系列产品的主要项目,它旨在通过选择性刺激食欲素受体来解决NT1中的食欲素缺乏问题。激活OX2R的激动剂可能替代内源性食欲肽,激活促进清醒的信号通路。
本次武田在中国启动了两项3期研究,其中一项为评价TAK-861治疗发作性睡病伴猝倒(发作性睡病1型)的疗效和安全性的随机、双盲、安慰剂对照研究,该研究拟通过清醒维持试验(MWT)评估TAK-861对EDS的影响。该研究拟在全球范围内入组93名受试者。另一项为评价TAK-861在患有选定中枢性睡眠过度疾病的受试者中的安全性和耐受性的长期扩展研究,研究拟在国际范围内入组500名受试者。
今年6月,武田宣布TAK-861在治疗1型发作性睡病的2b期临床试验中获得的积极结果。这是一项在112例NT1患者中进行的随机、双盲、安慰剂对照、多剂量2b期临床试验。结果显示,在8周内,主要终点和所有次要终点均实现具有统计学意义和临床意义的改善。
主要终点显示,在所有剂量下,与安慰剂相比,清醒维持试验(MWT)的睡眠潜伏期增加具有统计学意义和临床意义。次要终点(包括Epworth思睡量表(ESS)和每周猝倒率(WCR)中取得了和主要终点一致的结果,与安慰剂相比,思睡和猝倒频率的主观评估获得改善。由于这些持续的改善,试验中的大多数NT1患者在8周治疗期结束时MWT和ESS在正常范围内。在研究期间,没有出现严重的不良事件,安全性结果显示TAK-861总体上安全性和耐受性良好。
除了TAK-861,武田还在开发多种食欲素产品,用于其他涉及促食欲素生物学的适应症。包括TAK-360,一种口服OX2R激动剂,正在研究治疗2型发作性睡病和特发性嗜睡症,最近启动了一项1期试验,并获得了FDA快速通道资格;以及danavorexton (TAK-925),一种静脉注射OX2R激动剂,正在开展用于接受全身麻醉的中度至重度阻塞性睡眠呼吸暂停患者的2期试验。
在全球范围内,食欲素受体激动剂产品(包括OX1R和OX2R)还有望用于治疗失眠症、睡眠障碍、昼夜节律睡眠障碍、阿尔茨海默病、抑郁症等神经和精神系统疾病。公开资料显示,全球范围内也有数十款靶向食欲素受体的产品正在研发中。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..