美国 FDA 仿制药办公室(OGD)Iilun Murphy 在普享药协会(AAM)2024 年 GRx+Biosims 会议上表示,FDA 正在推出一项为期六个月的新试点计划,以在复杂监管问题上为仿制药申请人提供更多透明度。
Murphy 介绍指出,这项试点计划将于下个月推出,旨在响应行业的反馈,并将“尽可能向申请人提供有关仿制药申请延迟行动的问题性质的更多说明。”
FDA 将评估这种透明度的提高是否对行业有帮助。FDA 希望试点计划能够提高申请质量并增加更早的批准数量。
Murphy 表示,随着新问题的出现和 FDA 寻求解决方案,“如果我们对这个问题的看法对行业有帮助”,FDA 将提供更及时的指南。但同时,FDA 也将继续推进具体申请,因此在对单个申请采取行动和分享有关 FDA 当前想法的更广泛指南之间可能会存在延迟。
Murphy 强调仿制药申报中需要更好的数据质量和可靠性,并指出,约 40% 的仿制药在申报流程的第二轮审评中才获得批准,也就是说 40% 的获批仿制药曾收到过一封完全回应函(CRL)。
Murphy 在会上用一张幻灯片展示了 2023 财年仿制药申请在第一个审评周期被拒绝的原因:
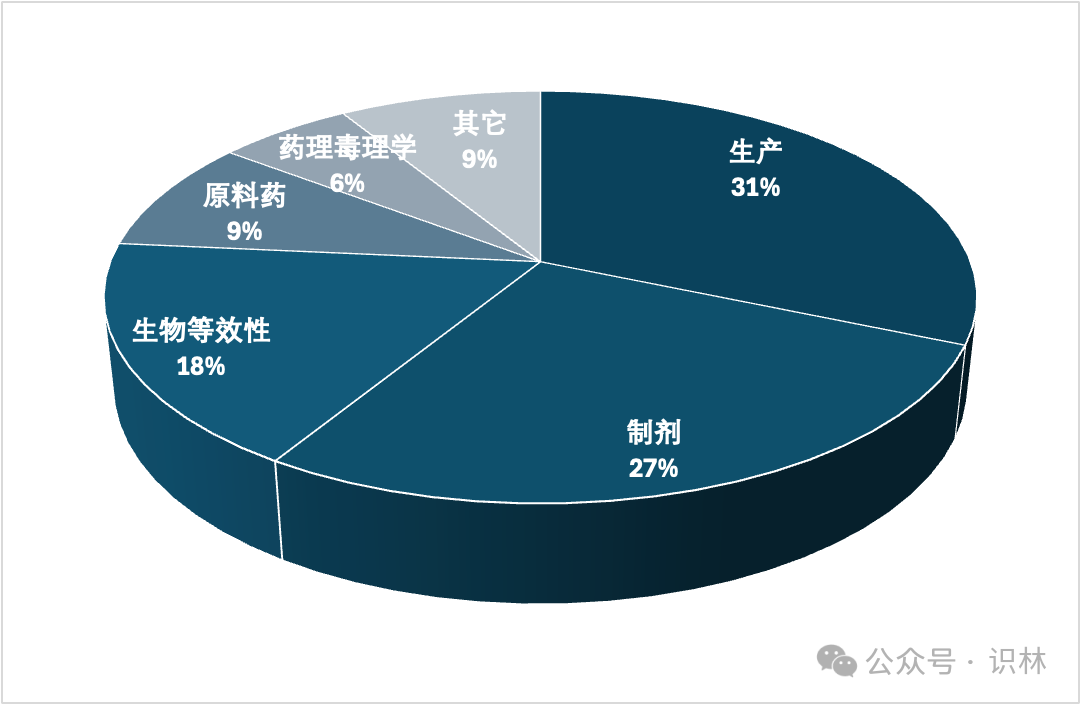
Murphy 表示,“我们希望减少ANDA获得批准所需的审评周期数”。她补充指出,去年仿制药办公室与申办人就产品开发和 CRL 后澄清问题举行了最多数量的会议。
仿制药使用者付费重新授权(GDUFA)在行业和 FDA 之间建立了几种新的会议类型,其中包括讨论具体产品指南的会议,ANDA 申请人可以通过这类会议从 FDA 获得关于新发布或修订的具体产品指南建议。但 Murphy 表示,“很奇怪,业界几乎没有有效利用这类会议。”
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..