9月23日,国家药典委公示了7个生物制品标准草案;除了生物制品生产用动物细胞基质制备及质量控制是第三次公示外,利妥昔单抗注射液、贝伐珠单抗注射液、阿达木单抗注射液、注射用英夫利西单抗、注射用曲妥珠单抗、注射用人促卵泡激素这6个品种标准草案为首次公示。
首次公示的6个生物制品标准草案修订内容:
标准包括氨基酸序列、分子式及分子量、基本要求、制造和检定等部分。其中,检定部分根据产品特点,分为原液检定和成品检定。对于检定部分,重点对各企业方法不一致的肽图、等电点、纯度、N 糖谱、生物学活性的方法等进 行了修订和统一。其他项目按照中国药典体例进行了文字规范。
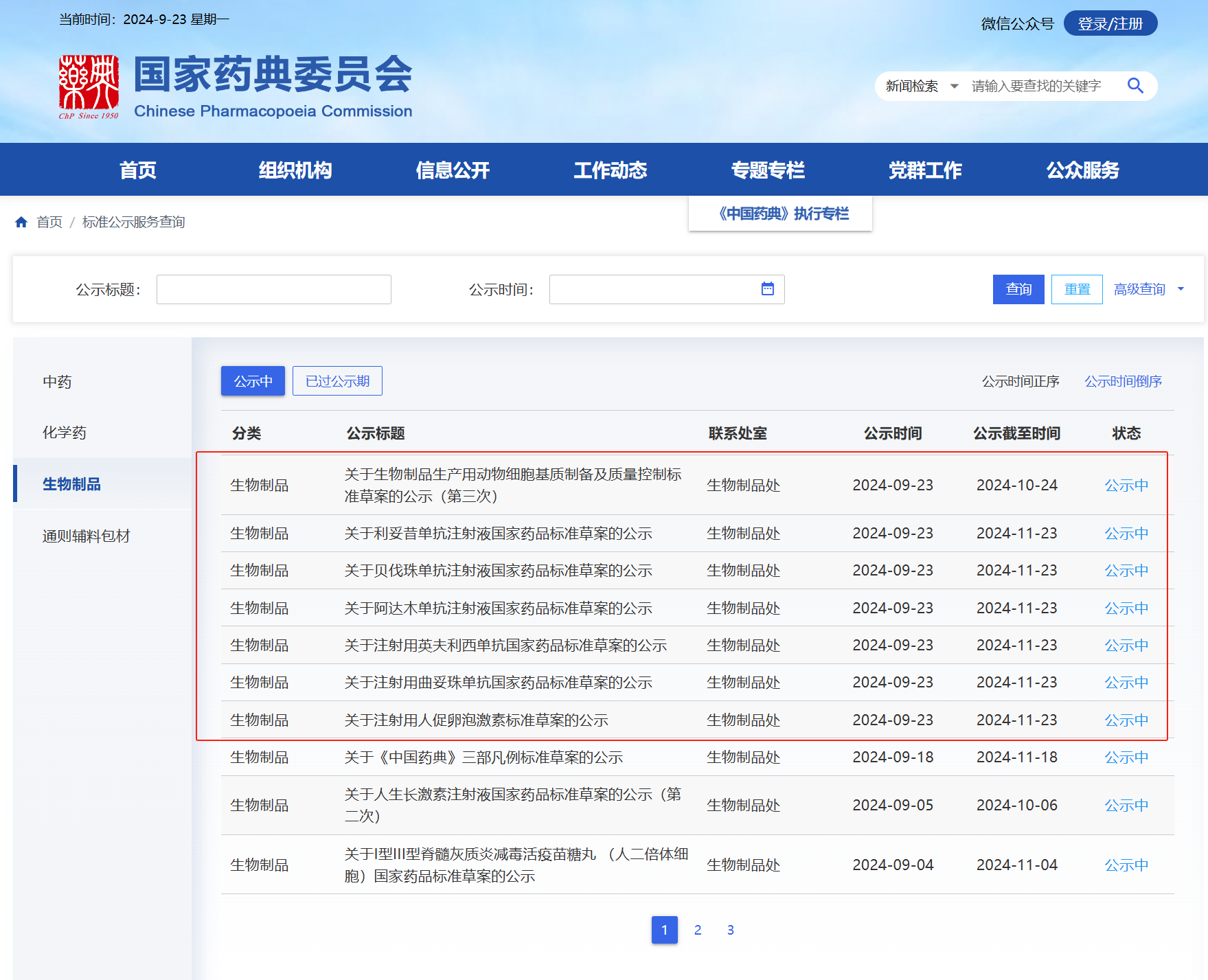
修订内容:
1、生物制品生产用动物细胞基质制备及质量控制
1、(P11 细 胞 系 / 株 来 源 资 料):参考国际要求,在细胞系/株来源资料的要求中,增加无法提供所有原材料信息的情况说明。
2、(P12 表 1.细胞检 定项目的 要求):参考国际要求,增加细胞种子的检定项目,增加稳定性 EOPC 的检测要求。
3、(P14(2) 体外培养 法检测病 毒因子):与通则 3302 描述一致,增加传 代时间的要求及增加指示细胞 不能进行血吸附试验的情况说明。
4、(P14 (3)动物 体内接种 法检测外 源病毒因 子) :正文部分增加进行动物体内接 种法的风险评估策略及接种动 物种类的选择策略,使要求更 为明确、内容更为连贯。
5、 (P16 二、新建 人二倍体 细胞株的 要求):参考国际要求,将 1000 个分裂 中期细胞检查修订为 200 个分 裂中期细胞的精细计数检查, 同时补充染色体结构异常的具 体描述,并增加“精细计数中如 发现除亚二倍体以外的染色体 异常分裂中期细胞,也应进行 核型分析做精细检查”的描述。删除 100 个分裂中期细胞的染 色体分析标准,同时增加 200 个分裂中期细胞的染色体分析 标准(该标准根据正常二倍体 细胞染色体异常的概率和可接 受置信区间利用二项分布公式 推算)。
6、( P13 (2)体外 不同指示 细胞接种 培养法检 测病毒因 子):样品保存温度由“-70℃或以下 保存”修订为“-60℃或以下保 存”。
2、利妥昔单抗注射液
本标准包括氨基酸序列、分子式及分子量、基本要求、制造和检定等部分。其中,检定部分根据产品特点,分为原液检定和成品检定。对于检定部分,重点对各企业方法不一致的肽图、等电点、纯度、N 糖谱、生物学活性的方法等进行了修订和统一。其他项目按照中国药典体例进行了文字规范。
3、贝伐珠单抗注射液
本标准包括氨基酸序列、分子式及分子量、基本要求、 制造和检定等部分。其中,检定部分根据产品特点,分为原液检定和成品检定。对于检定部分,重点对各企业方法不一致的肽图、纯度、电荷异构体、生物学活性的方法进行了修订和统一。其他项目按照中国药典体例进行了文字规范。
4、阿达木单抗注射液
本标准包括氨基酸序列、分子式及分子量、基本要求、 制造和检定等部分。其中,检定部分根据产品特点,分为原液检定和成品检定。对于检定部分,重点对各企业方法不一致的肽图、等电点、纯度、电荷异构体、生物学活性的方法等进行了修订和统一。其他项目按照中国药典体例进行了文 字规范。
5、注射用英夫利西单抗
本标准包括氨基酸序列、分子式及分子量、基本要求、 制造和检定等部分。其中,检定部分根据产品特点,分为原液检定和成品检定,未设置半成品检定。对于检定部分,重点对各企业方法不一致的鉴别、纯度、蛋白含量测定、生物学活性的方法进行了修订和统一。其他项目按照中国药典体例进行了文字规范。
6、注射用曲妥珠单抗
本标准包括氨基酸序列、分子式及分子量、基本要求、 制造和检定等部分。其中,检定部分根据产品特点,分为原 液检定和成品检定。对于检定部分,重点对各企业方法不一致的鉴别、纯度、蛋白含量测定、N 糖谱、生物学活性的方法进行了修订和统一。其他项目按照中国药典体例进行了文字规范。
7、注射用人促卵泡激素
本标准主要参考注册标准制定,在个别检项采用协作研究的新建方法,如毛细管实时成像等电聚焦鉴别、β 亚基 N 端缺失及总氧化亚基这三个检项采用了新建方法。另外,本标准原液中增加体外活性检项,暂未做限度规定。同时,按照 25 版药典体例规范了相关表述。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..