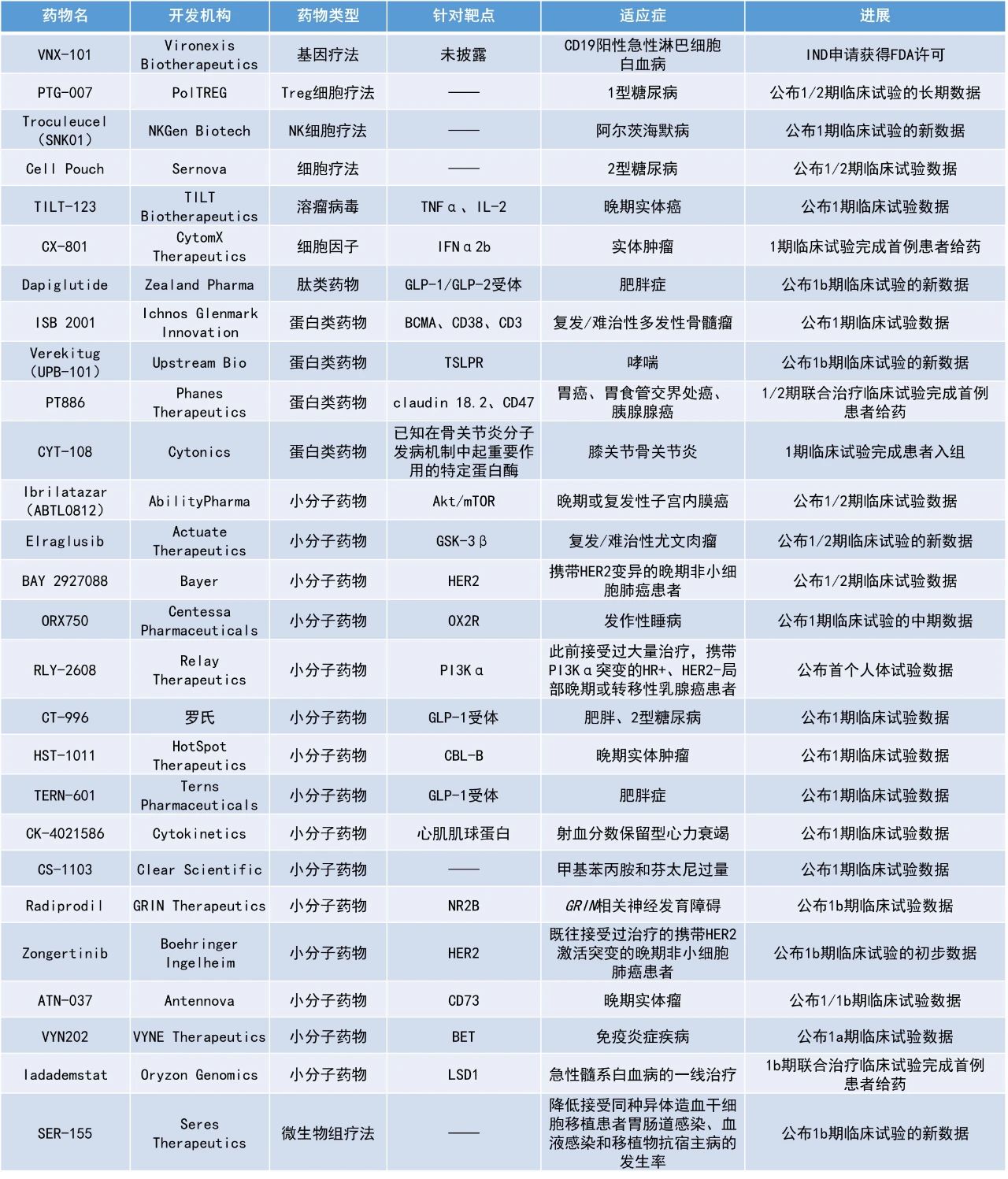
本期看点
Zongertinib:公布1b期临床试验的初步数据
勃林格殷格翰(Boehringer Ingelheim)公布了旗下口服HER2靶向疗法zongertinib(BI 1810631)在NSCLC患者中的最新积极临床结果。Zongertinib不与野生型表皮生长因子受体(EGFR)结合,进而相关毒性较低。Zongertinib于2023年获得美国FDA授予快速通道资格,并随后于2024年获得美国FDA和中国国家药监局药品审评中心(CDE)授予的突破性疗法认定,用于治疗曾接受过全身性疗法、携带HER2激活突变的晚期NSCLC成人患者。
此次公布的结果显示,截至2024年5月,共132例患者每天接受一次120 mg/240 mg zongertinib治疗(n=75/n=57)。经盲法独立中央审评(BICR)评估,试验达到主要终点,患者的确认ORR为66.7%(97.5% CI:53.8–77.5,p<0.0001)。在所有剂量的患者中,94%的患者观察到任何程度的肿瘤缩小。
此外,数据还显示,zongertinib具有初步的脑活性。根据BICR评估的RANO-BM(神经肿瘤脑转移瘤的疗效评估),33%(120 mg,n=27)和40%(240 mg,n=25)的无症状脑转移患者达成确认的客观缓解,疾病控制率(DCR)分别为74%和92%。Zongertinib在120 mg和240 mg剂量下的耐受性通常良好,没有因治疗导致的死亡,且导致剂量减少(11%)和停药(3%)的不良事件发生率低。
BAY 2927088:公布1/2期临床试验数据
拜耳(Bayer)公布了1/2期SOHO-01研究扩展部分的积极结果。该研究评估了其口服、可逆的HER2靶向疗法BAY 2927088在携带HER2变异的晚期NSCLC患者中的安全性和初步疗效。入组患者在接受≥1种晚期疾病全身治疗后病情出现进展,但未曾接受过HER2靶向治疗。BAY 2927088能够强效抑制突变的HER2,包括HER2外显子20插入突变和HER2点突变,同时也能抑制EGFR,对突变型EGFR具有高选择性,且不和野生型EGFR相结合。美国FDA和中国药品审评中心于2024年授予BAY 2927088突破性疗法认定,用于治疗携带HER2激活突变且曾接受过全身治疗的不可切除或转移性NSCLC成年患者。
此次公布的结果显示,43名可评估疗效患者的确认ORR为72.1%,1名(2.3%)患者实现完全缓解(CR)。中位缓解持续时间(DOR)和PFS分别为8.7个月和7.5个月。在携带HER2 YVMA插入突变(最常见的变异)的患者中,ORR为90.0%,DOR为9.7个月,PFS为9.9个月。此外,BAY 2927088的安全性是可控的,并且与之前的报告一致。
Ibrilatazar(ABTL0812):公布1/2期临床试验数据
AbilityPharma公司公布了ibrilatazar联用化疗(紫杉醇/卡铂)治疗晚期或复发性子宫内膜癌患者的1/2期临床试验ENDOLUNG的最终数据。Ibrilatazar是一种潜在“first-in-class”、差异化的口服靶向抗癌化合物,通过诱导内质网应激和抑制PI3K/Akt/mTOR通路来引发自噬。在临床试验中,ibrilatazar对子宫内膜癌和肺癌患者显示出临床益处。此外,它在包括肺癌、子宫内膜癌、胰腺癌、神经母细胞瘤和胶质母细胞瘤等癌症类型的动物模型中展示了强有力的临床前概念验证。
此次公布的结果显示,ibrilatazar联用化疗的总缓解率为65.8%,其中13.2%的患者达到CR,52.6%的患者达到部分缓解(PR),中位DOR为7.4个月。中位PFS为9.8个月,相比历史对照组延长了40%。中位总生存期(OS)为23.6个月。这些结果表明,接受ibrilatazar联用化疗治疗的患者的ORR、PFS和OS相较于历史对照组(分别为51%、7.1个月和20.4个月)均有所提高。
安全性方面,ibrilatazar联用化疗治疗显示出良好的安全性,未引入与化疗相关的重大不良事件,其安全性与历史对照组一致。药代动力学参数与临床前试验中观察到的靶点作用相符,血液药效学生物标志物表明治疗开始后至少28天内靶点调节持续存在。
RLY-2608:公布首个人体试验数据
Relay Therapeutics公司公布了其在研疗法RLY-2608的首个人体试验的积极中期数据。RLY-2608是Relay Therapeutics开发针对PI3Kα突变体的选择性抑制剂。该激酶是所有癌症中最常出现突变的激酶之一,约在14%的实体瘤患者检测出PI3Kα的致癌突变。传统上,PI3Kα抑制剂的开发聚焦于蛋白的活性位点。然而,这些抑制剂缺乏对突变型PI3Kα的选择性,导致治疗效果欠佳。为了增强PI3Kα抑制剂的选择性,Relay Therapeutics解析了PI3Kα的全长蛋白冷冻电镜结构,以阐明野生型和突变型PI3Kα的构象差异,并利用这些见解支持RLY-2608的设计。
此次公布的数据显示,此前接受过大量治疗,携带PI3Kα突变的HR阳性、HER2阴性局部晚期或转移性乳腺癌患者在接受RLY-2608(600 mg)联合fulvestrant治疗后,表现出具有临床意义的PFS。中位随访时间为7.5个月时,所有携带PI3Kα突变患者的中位PFS为9.2个月。在30名具有可测量疾病的患者中,1/3的患者达到PR,ORR为33%。新闻稿指出,RLY-2608是首个针对PI3Kα,具有突变体和异构体(isoform)选择性的别构抑制剂。
Mosliciguat:公布1b期临床试验数据
Roivant公司公布了其肺动脉高压(PH)疗法mosliciguat的1b期概念验证试验的结果。Mosliciguat是一种每日给药一次、潜在"first-in-class"和“best-in-class”的吸入性可溶性鸟苷酸环化酶(sGC)激动剂,可靶向递送至肺部。sGC是一种一氧化氮(NO)/环磷酸鸟苷(cGMP)信号通路中的关键酶,可催化cGMP生成,从而增加血管扩张、减少炎症和细胞凋亡、逆转血管重塑和抗纤维化作用。与需要减少血红素和NO才能对sGC产生作用的sGC激动剂不同,mosliciguat是一种独立于血红素和NO的sGC激活剂。这使mosliciguat可能在典型PH患者体内高氧化环境中保持有效性。该疗法目前正在开发用于治疗与间质性肺病(PH-ILD)相关的肺动脉高压。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..