公开资料显示,恩考芬尼目前已经获美国FDA获批多项适应症,包括于2018年获批与比美替尼(binimetinib,Mektovi)组合疗法治疗带有BRAF V600E或V600K突变的不可切除或转移性黑色素瘤患者。2020年,恩考芬尼被FDA批准与EGFR抑制剂西妥昔单抗(cetuximab)联用,用于治疗经前期治疗后产生BRAF V600E突变的转移性结直肠癌(CRC)成人患者。2023年10月,FDA再次批准恩考芬尼与比美替尼组合疗法治疗BRAF V600E突变的转移性非小细胞肺癌患者。
恩考芬尼是一种强效且具有高度选择性的BRAF抑制剂,通过抑制肿瘤细胞中表达多种突变形式的BRAF激酶(包括V600E)的RAF/MEK/ERK通路发挥作用;比美替尼是一种强效且具有选择性的MEK抑制剂。这两种药物通过抑制MAPK通路中的激酶来发挥作用,从而产生具有临床相关性的抗肿瘤活性。已有研究证明,许多BRAF V600突变的癌症都出现了MAPK通路激活不受控制的现象,包括黑色素瘤、结直肠癌和非小细胞肺癌。
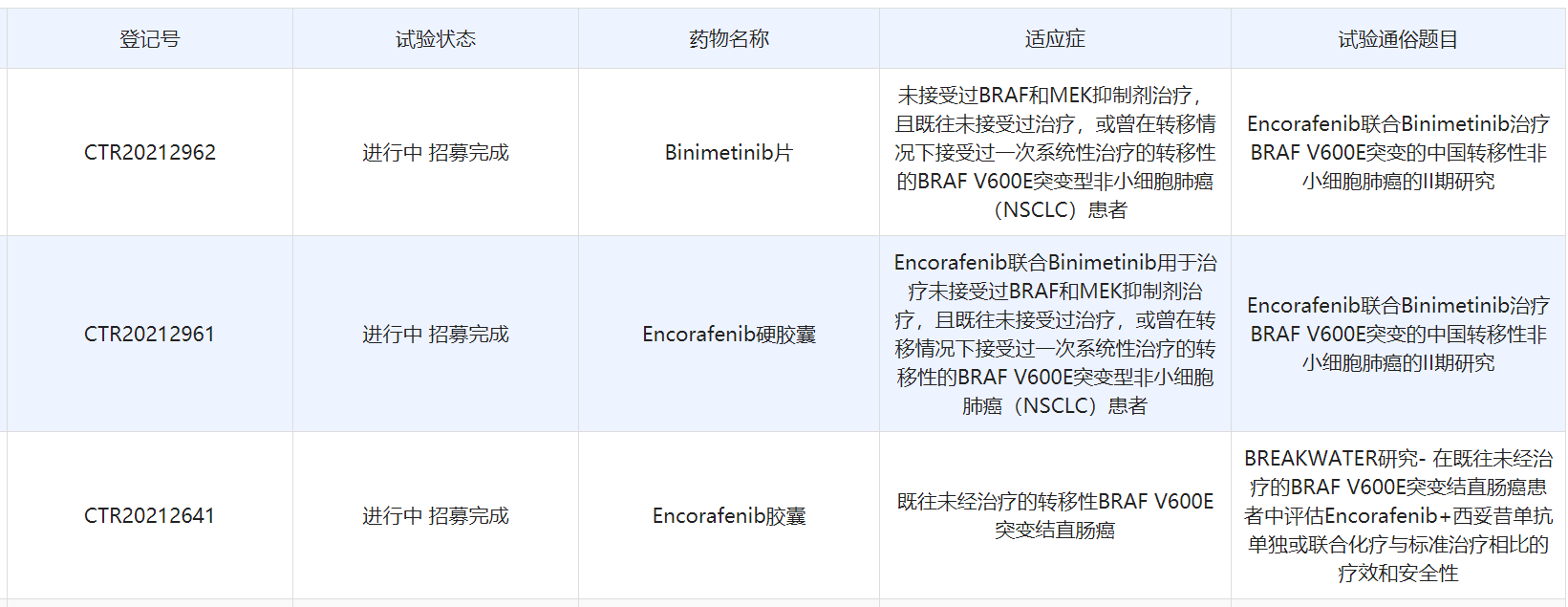
▲恩考芬尼在中国开展的临床研究
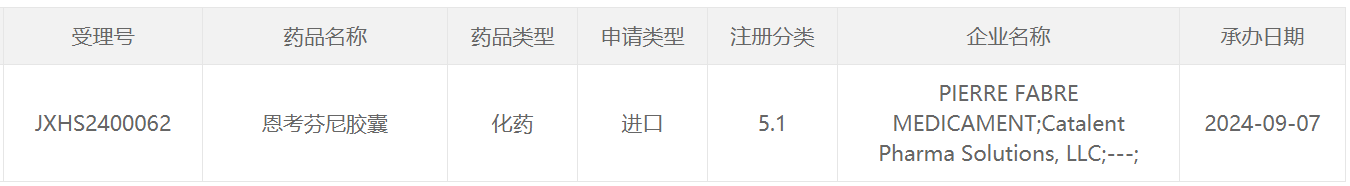
根据中国药物临床试验登记与信息公示平台官网,研究人员开展了恩考芬尼多项临床研究,其中进入3期阶段的研究为一项在转移性BRAF V600E突变结直肠癌受试者中比较一线恩考芬尼 + 西妥昔单抗联合或不联合化疗与标准治疗、包含恩考芬尼 + 西妥昔单抗联合化疗安全性导入试验(SAFETY LEAD-IN)的开放性、多中心、随机3期研究。根据该临床研究进展推测,本次恩考芬尼胶囊在中国申报上市的适应症为结直肠癌。
FDA和欧盟此前批准该项适应症的是基于关键性3期BEACON CRC试验的结果,该试验在北美、南美、欧洲和亚太地区的200多个研究中心开展。接受恩考替尼联合西妥昔单抗治疗患者的中位总生存期(OS)为8.4个月,而对照组(伊立替康联合西妥昔单抗或FOLFIRI联合西妥昔单抗)为5.4个月。此外,恩考替尼联合西妥昔单抗治疗的客观缓解率(ORR)为20%,而对照组为2%。
该研究结果表明,与对照组相比,恩考芬尼联合西妥昔单抗可显著提高BRAF V600E突变型mCRC患者的总生存率 (两组相差3.7个月),死亡风险降低40%,耐受性良好,未发生预期以外的毒性反应。
根据公开资料查询,恩考芬尼与比美替尼这两款产品的权益牵涉到多项国际药企的收购和授权合作。根据皮尔法伯最近发布的新闻稿,目前辉瑞拥有Braftovi®和Mektovi®在美国、加拿大以及拉丁美洲、非洲和中东地区所有国家的独家商业权利。小野制药有限公司拥有这两种产品在日本和韩国的独家商业权,Medison拥有以色列的独家商业权,皮尔法伯拥有这两种产品在所有其他国家(包括欧洲和亚太地区)的独家商业权。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..