8月28日,中国国家药监局药品审评中心(CDE)官网最新公示,阿斯利康(AstraZeneca)申报的acalabrutinib Maleate片上市申请已获得受理。公开资料显示,acalabrutinib(通用名:阿可替尼胶囊)是一款布鲁顿氏酪氨酸激酶(BTK)抑制剂,此前已经在中国获批两项适应症。根据阿斯利康官网管线信息,推测此次阿可替尼申报上市的新适应症可能是一线治疗慢性淋巴细胞白血病(CLL)。
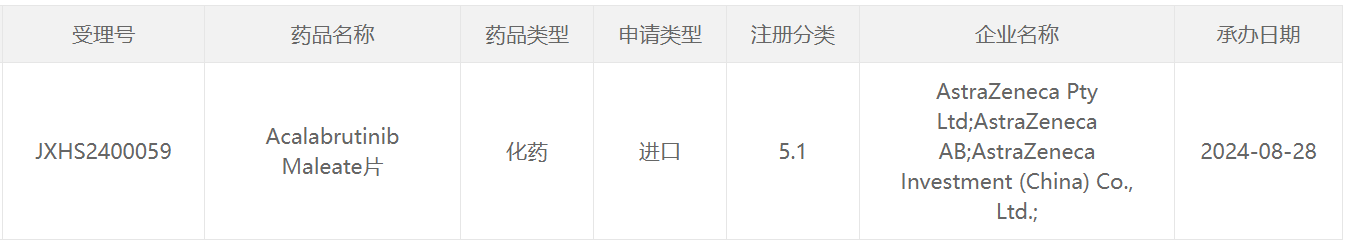 截图来源:CDE官网
截图来源:CDE官网
阿可替尼是新一代高选择性原研BTK抑制剂,通过与BTK共价结合抑制其活性。在B细胞中,BTK信号导致B细胞增殖、转运、趋化和粘附所需的途径激活。在中国,阿可替尼于2023年3月首次获批上市,用于治疗既往至少接受过一种治疗的成人套细胞淋巴瘤(MCL)患者;于2023年9月获批第二项适应症,单药适用于既往至少接受过一种治疗的成人慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)患者。今年4月,阿斯利康宣布,在一项中国牵头的3期ChangE临床试验中,阿可替尼显示出对未经治疗的慢性淋巴细胞白血病(CLL)患者具有统计学和临床意义的无进展生存期获益。ChangE是一项由中国牵头的随机、多中心、开放标签3期临床试验,其中66%的患者来自中国(包括中国台湾地区)。该试验旨在评估阿可替尼与苯丁酸氮芥联合利妥昔单抗相比,对未经治疗的CLL患者的安全性和有效性。ChangE临床试验的主要结果显示,阿可替尼达到了其主要终点,与苯丁酸氮芥和利妥昔单抗联合方案相比,在所有预先指定的亚组中均显示出统计学上显著且临床上有意义的无进展生存期(PFS)改善。该试验还显示,与苯丁酸氮芥和利妥昔单抗联合治疗相比,总体生存期 (OS) 益处有改善趋势。
阿斯利康此前在新闻稿中表示,ChangE结果进一步证实了阿可替尼作为单药对比目前中国慢性淋巴细胞白血病常规治疗的优势。ChangE和之前在广泛的慢性淋巴细胞白血病患者群体中开展的全球3期ELEVATE-TN试验的积极结果,将为今年晚些时候提交给中国监管部门的申请奠定基础。
慢性淋巴细胞白血病(CLL)是成人中最常见的慢性白血病类型。在CLL中,骨髓中过多的造血干细胞变成了异常淋巴细胞,这些异常细胞难以抵抗感染。随着异常细胞数量的增加,健康的白细胞、红细胞和血小板的空间就会减少。这可能导致贫血、感染和出血。通过BTK的B细胞受体信号传导是CLL的重要生长途径之一。值得一提的是,在国际范围内,今年7月,阿斯利康宣布,3期临床试验AMPLIFY的中期分析获得积极结果。在该研究中,阿可替尼与venetoclax联用,含或不含obinutuzumab,在初治成人慢性淋巴细胞白血病(CLL)患者中,与标准化学免疫疗法相比,显著提高了患者无进展生存期(PFS),具有统计学显著性和临床意义。期待更多的好消息传来,为更多的慢性淋巴细胞白血病患者带来新的治疗选择。
 截图来源:CDE官网
截图来源:CDE官网