本期看点
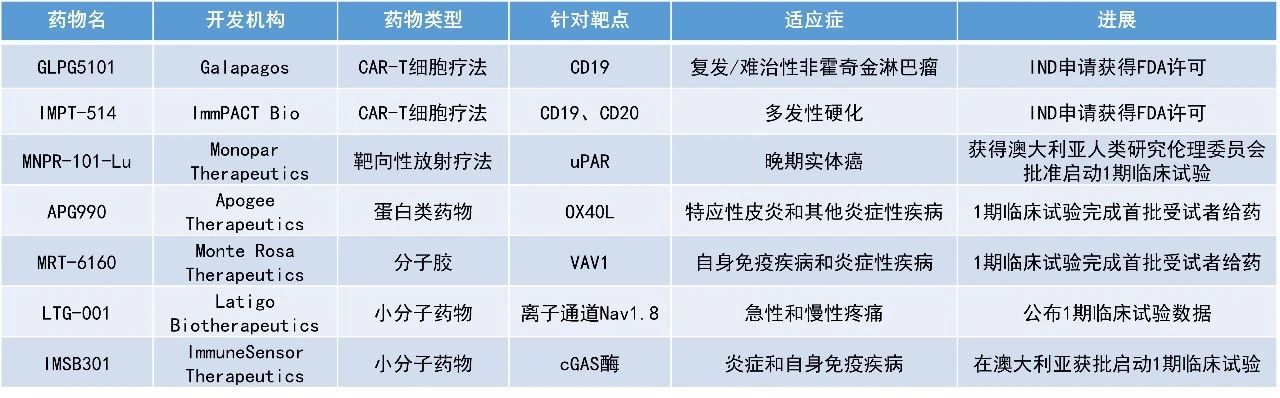
GLPG5101:IND申请获得FDA许可
Galapagos公司宣布,其CD19靶向候选CAR-T细胞疗法GLPG5101治疗复发/难治性非霍奇金淋巴瘤的IND申请已获FDA批准。
此前,该公司公布了在欧洲开展的1/2期ATALANTA-1研究的积极结果。截至2023年12月20日的数据,在研究的第一部分,中位随访时间为13.1个月,接受GLPG5101治疗的16例可评估的复发/难治性NHL患者的ORR为87.5%(14/16),完全缓解率(CRR)为75%(12/16)。71%的患者在数据截止时保持缓解。在研究的第二部分,中位随访时间为4.2个月,15例可评估患者的ORR和CRR均为93.3%(14/15)。100%的患者在数据截止时持续缓解。安全性方面,大多数治疗伴发不良事件为1/2级,在研究的第一部分观察到2例3级细胞因子释放综合征(CRS),在研究的第二部分观察到1例3级免疫效应细胞相关神经毒性综合征(ICANS)。
MNPR-101-Lu:获得澳大利亚人类研究伦理委员会批准启动1期临床试验
Monopar Therapeutics公司宣布已获得澳大利亚人类研究伦理委员会批准,将启动其新型放射性药物MNPR-101-Lu治疗晚期实体瘤的1期临床试验。MNPR-101-Lu结合了治疗性放射性同位素镥-177和该公司专有的对尿激酶纤溶酶原激活受体(uPAR)具有高度选择性的人源化单克隆抗体MNPR-101。
在一项为期90天的临床前疗效研究中,给人类胰腺癌异种移植小鼠模型单次注射MNPR-101-Lu后即显示出持久的抗肿瘤效果,在研究期间肿瘤完全消失。影像学数据表明,相对于正常组织,MNPR-101-Lu在肿瘤中具有高特异性,并会被持久摄取。
LTG-001:公布1期临床试验数据
Latigo Biotherapeutics公司宣布,其潜在“best-in-class”非阿片类止痛药候选药物LTG-001的1期临床试验结果良好。LTG-001是一种口服、选择性Nav1.8抑制剂,正在开发用于从根源治疗急性和慢性疼痛。
在72名健康受试者中进行的1期临床试验结果表明,LTG-001的耐受性良好,吸收迅速,Tmax(达到最大浓度的时间)约为1.5小时,药代动力学特征可预测,暴露量在整个剂量范围内呈比例增加。快速缓解疼痛对于急性和慢性疼痛的管理至关重要,在本研究中,LTG-001在给药后两小时内就能达到Tmax表明该候选疗法有望快速缓解疼痛。此外,研究剂量下未显示食物影响。
APG990:1期临床试验完成首批受试者给药
Apogee Therapeutics公司宣布其用于治疗特应性皮炎(AD)和其他炎症性疾病的新型半衰期延长型OX40L靶向抗体APG990的1期临床试验已完成首批受试者给药。与IL-13或IL-4Rα相比,OX40L位于炎症通路的更上游,以其为靶点有可能通过抑制1型、2型和3型通路对炎症级联产生更广泛的影响。目前获批的生物制品只针对AD的两种作用机制(IL-13和IL-4Rα),OX40L有望成为患者的另一种治疗选择,尤其是那些无法从现有治疗中获益的患者。临床前研究结果显示,APG990有潜力实现每3到6个月用药一次的维持治疗,与第一代OX40L抗体(预计每4到12周用药一次)相比将是重大改进。
IMSB301:在澳大利亚获批启动1期临床试验
ImmuneSensor Therapeutics公司宣布,其cGAS酶抑制剂候选药物IMSB301获澳大利亚监管机构批准,可启动首次人体1期临床试验。在一些自身免疫性疾病中,cGAS通路可能异常激活,导致过度的炎症反应和组织损伤。IMSB301是一种新型、可口服的小分子药物,旨在通过抑制cGAS酶阻止病理性炎症的形成。
在临床前研究中,IMSB301被证明是一种强效且具特异性的cGAS酶活性抑制剂,可以显著抑制Aicardi-Goutières综合征(AGS)模型中细胞因子的产生,减轻或逆转疾病症状并避免过早死亡。ImmuneSensor公司计划首先在cGAS驱动的I型干扰素病(包括AGS和系统性红斑狼疮)中开发IMSB301。IMSB301有潜力用于治疗其他由cGAS驱动的炎症相关的多种疾病,包括糖尿病肾病、年龄相关性黄斑变性及其他自身免疫性疾病。
MRT-6160:1期临床试验完成首批受试者给药
Monte Rosa Therapeutics公司宣布,在一项评估MRT-6160的1期临床试验中,首批受试者已经开始用药。MRT-6160是一种强效、高选择性、口服生物可利用的在研分子胶降解剂(MGD),靶向VAV1。在临床前研究中,MRT-6160能够深度降解VAV1,但对其他蛋白质没有能检测到的影响,并且可以在几种体内自身免疫模型中抑制疾病进展。
VAV1是T细胞和B细胞受体下游的关键信号蛋白,其表达仅限于血液和免疫细胞,包括T细胞和B细胞。临床前研究表明,通过MGD靶向降解VAV1蛋白可以调节T细胞和B细胞受体介导的活性。这种调节在体外和体内都很明显,表现为细胞因子分泌的显著减少。此外,靶向VAV1的MGD在自身免疫性疾病的临床前模型中显示出有前景的活性,因此有可能在多种自身免疫适应症中提供治疗益处,如炎症性肠病、类风湿关节炎、多发性硬化和皮肤病。
IMPT-514:IND申请获得FDA许可
ImmPACT Bio公司宣布,美国FDA已经批准了其CD19/CD20双特异性CAR-T细胞疗法IMPT-514的IND申请,用于治疗多发性硬化(MS)成年患者。IMPT-514采用了强效双特异性CAR和4-1BB共刺激结构域,CD19/CD20双重靶向旨在实现致病性自身免疫细胞的广泛耗竭。在临床前研究中,IMPT-514可高效地从重度免疫抑制的多种自身免疫性疾病患者体内制造出来,并显示出强效的自体B细胞清除能力和温和的细胞因子特征。根据新闻稿,IMPT-514是首个已知开发中用于治疗MS的CD19/CD20双重靶向CAR-T细胞疗法。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..