本期看点
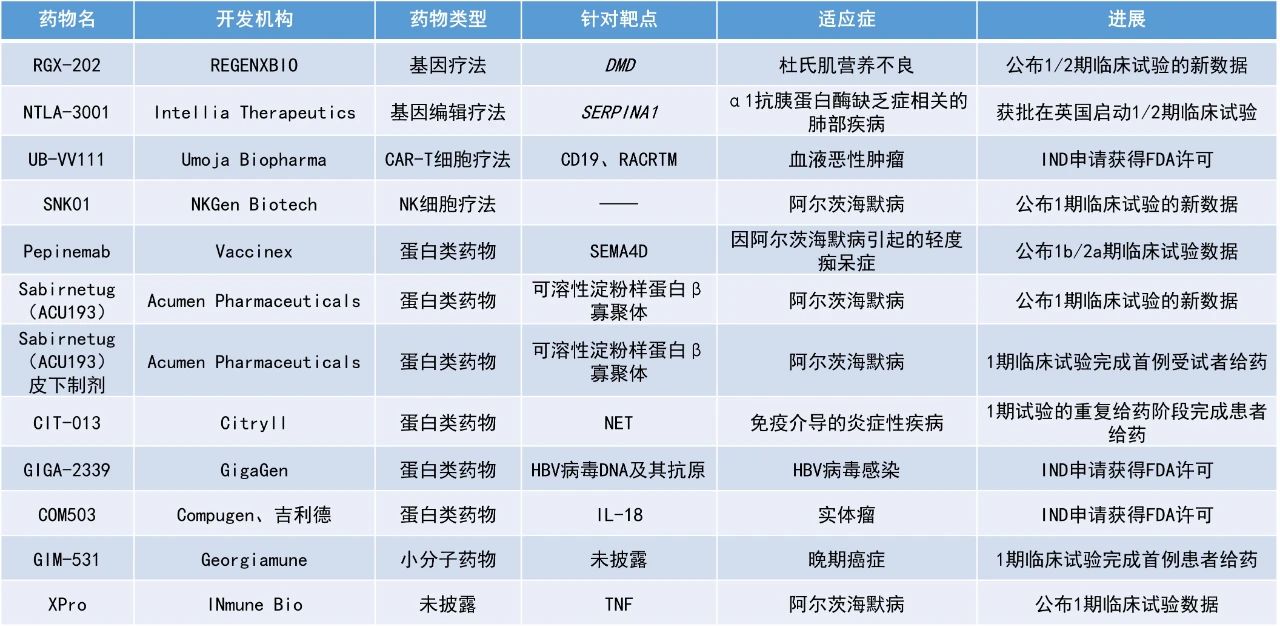
1. 治疗阿尔茨海默病(AD)的自然杀伤(NK)细胞疗法SNK01在一项1期临床试验中使90%患者的认知功能稳定或有改善。
2. FDA批准了能在体内制造嵌合抗原受体(CAR)-T细胞的创新疗法UB-VV111的IND申请,预计将于今年年底前启动1期临床试验。
3. 有望功能性治愈乙型肝炎病毒(HBV)感染的重组多克隆抗体疗法GIGA-2339获许可进入临床。
SNK01:公布1期临床试验的新数据
NKGen Biotech公布了其在研NK细胞疗法SNK01治疗阿尔茨海默病患者的临床试验数据。SNK01是一款自体、非基因工程改造的NK细胞产品,它具有增强的细胞毒性,活化受体表达率超过90%,可从任何供体中稳定生产。该候选疗法能够有效降低AD患者脑脊液(CSF)中的α-突触核蛋白(α-syn)水平,该蛋白的升高被认为与认知能力下降有关。目前,已批准的AD疗法均未将α-syn作为靶点。
此前公布的1期试验结果显示,SNK01除了先前披露的对淀粉样蛋白β(Aβ)和神经炎症生物标志物的积极影响外,对晚期AD患者的认知功能也具有临床疗效。在10名可评估的AD患者中,90%患者的阿尔茨海默病综合评分(ADCOMS,一种反映患者认知功能的评分)较基线时有改善或保持稳定。
此次公布的结果显示,尽管70%的受试者接受的是相对低剂量的SNK01治疗,仍有60%的受试者(6/10)的CSF α-syn水平较基线时有所下降。第11周时,6名患者中有5名受试者的α-syn下降与ADCOMS的稳定/下降相对应。安全性方面,没有观察到与治疗相关的不良事件。AD受试者对SNK01的耐受性良好,在所有测试剂量下均未观察到剂量限制性毒性。该公司表示,这些数据值得在更大剂量、更长疗程、更大规模的2期试验中进一步研究。
UB-VV111:IND申请获得FDA许可
Umoja Biopharma宣布,美国FDA已批准其在研CD19靶向原位生成(in-situ generated)CAR-T细胞疗法UB-VV111的IND申请,用以治疗血液恶性肿瘤。Umoja预计将在2024年底前启动1期试验并进行首位患者给药。根据新闻稿,UB-VV111可能是血液学人体试验中首个原位生成CD19靶向CAR-T细胞疗法。
UB-VV111是一款通过VivoVec平台开发的体内CAR-T细胞疗法。UB-VV111包含一个表面经过工程化的病毒包膜,以及编码CD19靶向CAR和雷帕霉素激活细胞因子受体(RACRTM)的转基因,旨在于患者体内扩增UB-VV111工程化CAR-T细胞。该疗法是VivoVec基因递送平台进入临床的首个管线。
GIGA-2339:IND申请获得FDA许可
GigaGen公司宣布,美国FDA已批准其IND申请,将于2024年第四季度启动一项1期试验,以评估该公司首款用于治疗HBV感染的重组多克隆抗体疗法GIGA-2339。GIGA-2339采用GigaGen的下一代平台开发,含有1000多种全人重组抗HBV抗体,旨在复制人体的自然免疫反应。GIGA-2339的效力是血浆衍生HBV药物的2000多倍,涵盖了广泛的循环HBV变异。在小鼠模型中,GIGA-2339中和并清除了HBV的病毒DNA及其抗原。通过这种独特的作用机制,GIGA-2339有可能清除病毒颗粒并激活免疫反应,从而提供HBV感染患者的功能性治愈。
Sabirnetug(ACU193):公布1期临床试验的新数据
Acumen Pharmaceuticals公司公布了sabirnetug(ACU193)用于治疗AD的1期临床试验的新结果。Sabirnetug是一种选择性靶向毒性可溶性β淀粉样蛋白寡聚体(AβOs)的人源化单克隆抗体。Sabirnetug能够结合AβOs,由于其独特的结合特性,sabirnetug有可能在产生淀粉样蛋白相关成像异常(ARIA,一种抗体疗法产生的常见主要副作用)风险较低的情况下提供治疗益处,因为sabirnetug可以在不直接靶向淀粉样斑块的情况下阻断AβOs的毒性作用。
此次公布的结果显示,接受sabirnetug给药3次可显著降低患者脑脊液中突触前和突触后蛋白水平,这与sabirnetug抑制AβOs突触结合的作用机制一致。VAMP2是一种与突触损伤相关的生物标志物,在所有多剂量递增组中均显著降低,似乎是该研究中发现的对sabirnetug最敏感的生物标志物。Acumen公司计划在正在进行的为期18个月的2期临床试验中评估生物标志物的长期变化及其与临床结果的关系,以进一步证实sabirnetug的作用机制。此外,Acumen公司还宣布了sabirnetug皮下制剂治疗早期AD的1期临床试验已完成首例受试者给药。
Pepinemab:公布1b/2a期临床试验数据
Vaccinex公司公布了pepinemab治疗AD的1b/2期试验数据的良好初步结果。Pepinemab是一种人源化IgG4单克隆抗体,旨在阻断SEMA4D与plexin-B1受体结合,从而避免引发细胞内肌动蛋白细胞骨架的崩溃,以及进一步导致的大脑中星形胶质细胞和其他胶质细胞以及免疫组织中树突状细胞的稳态功能丧失。
此次公布的结果证实了以激活星形胶质细胞为目标的新型作用机制有望延缓AD从早期轻度认知障碍发展为老年痴呆症的进程。该研究结果与此前pepinemab治疗亨廷顿病的2期临床试验结果类似,因为AD与亨廷顿病在神经免疫病理学方面具有相似性。
RGX-202:公布1/2期临床试验的新数据
REGENXBIO公司宣布,其在研杜氏肌营养不良症(DMD)基因疗法RGX-202在治疗1至11岁DMD患者的1/2期临床试验中获得了积极的中期安全性和疗效数据。在接受关键性临床试验推荐剂量(剂量水平2)的RGX-202治疗的5.8岁和8.5岁患者中,接受治疗后三个月时微抗肌营养不良蛋白表达水平分别为健康对照组的77.2%和46.5%。
RGX-202是一种一次性基于腺相关病毒载体(AAV)的基因疗法,它编码包含天然抗肌营养不良蛋白C端(CT)结构域的微抗肌营养不良蛋白,以更好地模拟天然蛋白的功能。临床前研究中,CT结构域已被证明可以保护肌肉免受收缩引起的应力,并提高其自我修复的能力。
XPro:公布1期临床试验数据
INmune Bio公司公布了其下一代肿瘤F坏死因子(TNF)抑制剂XPro用于治疗AD的1b期临床试验结果。XPro的作用与现有的TNF抑制剂不同,它能中和可溶性TNF(sTNF),而不影响跨膜TNF(tmTNF)或TNF受体。XPro可在不抑制免疫的情况下减轻神经炎症,从而对神经系统疾病患者产生潜在的实质性益处。此次公布的结果显示,接受XPro治疗12周后,患者的突触蛋白发生了显著变化,而突触蛋白对神经元之间的交流至关重要。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..