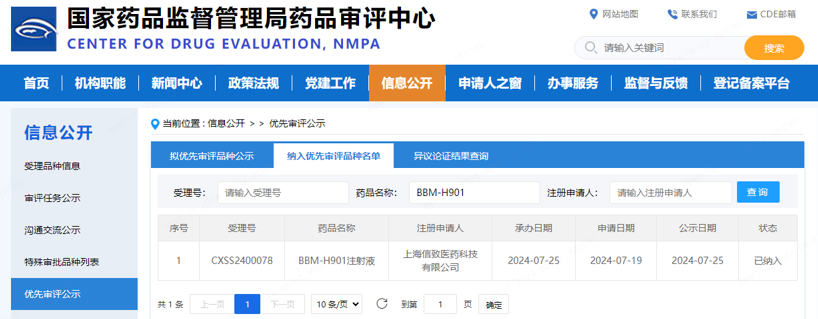
2024年8月2日,信念医药集团(Belief BioMed,BBM,下称“信念医药”)宣布:国家药品监督管理局(NMPA)已将BBM-H901注射液用于治疗血友病B成年患者的新药上市申请(NDA)纳入优先审评审批程序。 在中国,“血友病”早在2018年就被收录于《第一批罕见病目录》1 。作为国家1类创新药,BBM-H901注射液也已在2022年被国家药品监督管理局纳入突破性治疗品种名单。故而该产品属于“临床急需的防治罕见病的创新药”,亦为“纳入突破性治疗药物程序的药品”,符合药品上市许可申请的优先审评审批条件。 国家药品监督管理局药品审评中心官网信息 信念医药将积极配合监管机构的专业审核,全面推动BBM-H901注射液的早日获批和患者可及。与此同时,公司亦将广泛布局多维治疗领域,致力解决未被满足的临床需求,促进中国源头创新,赋能全球患者健康,在践行企业使命的旅程中踔厉奋发、笃行不怠! 注释 1http://www.nhc.gov.cn/yzygj/s7659/201806/393a9a37f39c4b458d6e830f40a4bb99.shtml 关于BBM-H901 关于信念医药
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..