7 月已经接近尾声。根据 Insight 数据库,截至发稿时,七月共有 11 款抗肿瘤新药向 CDE 递交上市申请。有 4 款新药为首次申报上市,其中 3 款为 1 类新药,它们均创造了某个细分领域的「首个」记录。此外,还有多款新药递交了新适应症的上市申请。
精准生物:普基仑赛注射液
作用机制:靶向 CD19 的 CAR-T
7 月 20 日,CDE 受理了精准生物的 1 类新药普基仑赛注射液的首次新药上市申请(受理号 CXSS2400075/6),拟用于治疗 3-21 岁患有 CD19 阳性复发/难治性急性淋巴细胞白血病(ALL)的患者。此前,该药已被 CDE 纳入突破性治疗药物品种和优先审评品种。
普基仑赛注射液研究进度时光轴
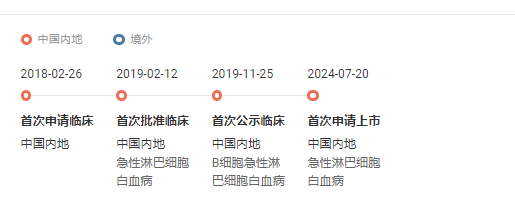
截图来自:Insight 数据库网页版
普基仑赛注射液(pCAR-19B)的 Ⅰ 期临床试验数据显示,入组的 9 例患者均获得完全缓解 (CR),总体缓解率达 100%,而且首次达到完全缓解的患者微小残留病变(MRD)也均为阴性。此外,临床试验中无剂量限制性毒性(DLT)以及治疗相关死亡事件发生,总体安全性和耐受性良好。
根据 Insight 数据库,目前国内已有 3 款靶向 CD19 的 CAR-T 产品获批上市,分别为复星凯特的阿基仑赛、药明巨诺的瑞基奥仑赛、合源生物的纳基奥仑赛。此外,还有 2 款 CD19 靶向 CAR-T 已申报上市,分别为恒润达生的润达基奥仑赛和精准生物的普基仑赛注射液。不过,从适应症来看,精准生物的普基仑赛是国内首款申报上市的治疗儿童白血病的 CAR-T 产品。
正大天晴:库莫西利胶囊
作用机制:CDK2/4/6 抑制剂
7 月 19 日,CDE 受理了正大天晴 1 类新药库莫西利胶囊的首次新药上市申请(受理号 CXHS2400055/6)。该药本次申报上市的适应症为:联合氟维司群注射液用于既往内分泌经治的激素受体(HR)阳性、人表皮生长因子受体 2(HER2)阴性的局部晚期或转移性乳腺癌患者。
库莫西利是一种 CDK2/4/6 抑制剂,它对 CDK2、CDK4、CDK6 激酶有不同程度的抑制效果,并且对 CDK4 激酶具有较强的抑制能力。库莫西利联合氟维司群用于既往内分泌经治的 HR+/HER2- 局部晚期或转移性乳腺癌的 III 期临床试验(NCT05375461)已完成期中分析。经独立数据监查委员会(IDMC)审核,该试验已达到预设的主要终点。
根据 Insight 数据库,正大天晴的库莫西利是国内首款、同时也是全球首款申报上市的 CDK2/4/6 抑制剂。此外,还有多款 CDK2/4/6 抑制剂已在国内进入临床阶段,包括同源康的 TY-0540、石药集团的 SYH2043、锐格医药的 RGT-419B、辰欣药业的 WXWH-0240、复星医药的 FN 1501。
和黄医药/Epizyme:氢溴酸他泽司他片
作用机制:EZH2 甲基转移酶抑制剂
7 月 4 日,CDE 受理了和黄医药联合申报的 5.1 类新药氢溴酸他泽司他片的上市申请(JXHS2400046),拟用于治疗 EZH2 突变阳性且既往接受过至少两种系统性治疗的复发或难治性滤泡性淋巴瘤 (FL) 成人患者。该申请也已被 CDE 纳入优先审评。
他泽司他是由益普生旗下 Epizyme 公司开发的一款 EZH2 甲基转移酶抑制剂。和黄医药通过战略合作获得了在中国内地、香港、澳门和台湾进行他泽司他的研究、开发、生产以及商业化的权益。
据悉本次在中国的上市申请得到了一项在中国开展的多中心、开放标签的 II 期桥接试验,以及 Epizyme 在中国以外地区开展的临床研究的支持。其中,在中国开展的 II 期桥接研究共纳入 42 名患者,研究的主要目的是评估他泽司他用于治疗伴有 EZH2 突变的复发/难治性 FL 患者的客观缓解率 (ORR)。
根据 Insight 数据库,他泽司他是首个在国内申报上市的 EZH2 抑制剂。此外,还有多款 EZH2 抑制剂已在国内进入临床,分别为恒瑞医药的 SHR2554、信诺维的 XNW 5004、海和药物的 HH 2853、中科拓苒的 TR 115、辉瑞的 Mevrometostat。
罗氏:阿替利珠单抗注射液(皮下注射)
作用机制:PD-L1 抑制剂
7 月 27 日,CDE 受理了罗氏阿替利珠单抗注射液(皮下注射)的上市申请(受理号:JXSS2400063/4)。全球范围内,该药已经在去年 8 月、今年 1 月陆续在英国、欧盟获批上市。
皮下(SC)注射剂的治疗优势在于其给药便捷性,罗氏的阿替利珠单抗皮下注射版仅需约 7 分钟即可完成注射,而原本的静脉(IV)输注则需要 30 - 60 分钟。其申报并获批之后,适应症也将适用于此前静脉制剂已获批的所有适应症,涵盖肺癌、膀胱癌、乳腺癌和肝癌。
此前,阿替利珠单抗皮下注射剂在英国的获批是基于 Ib/III 期临床试验 IMscin001(NCT03735121)的结果。这项研究旨在比较既往铂类治疗失败的局部晚期或转移性 NSCLC 患者中阿替利珠单抗皮下制剂与静脉注射的药代动力学、安全性和有效性。数据显示,皮下注射和静脉输注组两者的 ORR(11.8% vs 9.7%)及中位 PFS(2.8 个月 vs 2.9 个月)相当,且在安全性方面也呈现一致性。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..