本期看点
1. 罗氏(Roche)潜在“best-in-class”皮下注射多肽减肥疗法CT-388在1期临床试验中使近半肥胖和2型糖尿病患者减重超20%。
2. 罗氏潜在”best-in-class“口服小分子疗法CT-996在1期临床试验中使肥胖且无2型糖尿病的患者1个月减重超6%。
3. 靶向多种KRAS突变的小分子疗法RMC-6236在一项1b期临床试验中使近90%的胰腺导管腺癌(PDAC)患者的疾病得到控制。
4. 外用前列腺素F2α类似物候选产品DLQ01在一项早期临床试验中使83%雄激素性脱发(AGA)男性患者的毛发密度在统计学上显著增加。
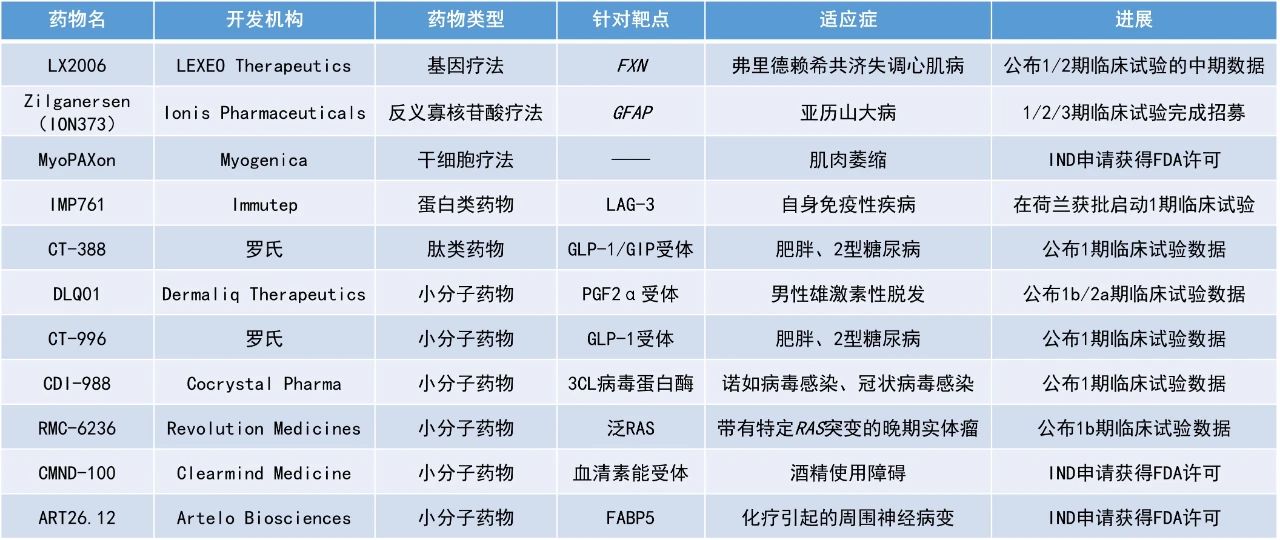
CT-388:公布1期临床试验数据
罗氏公布了其在研、潜在“best-in-class”葡萄糖依赖性促胰岛素多肽(GIP)和胰高血糖素样肽-1(GLP-1)受体双重激动剂CT-388用于治疗肥胖和2型糖尿病患者的1期临床试验的详细结果。CT-388是一款每周一次皮下注射的多肽疗法,对GLP-1和GIP受体均具有强效活性,但最小化β-arrestin募集至任一受体。这种偏向信号可显著减少受体内化和随之而来的脱敏现象,预计可延长药物的药理活性。罗氏在2023年12月斥资约31亿美元收购Carmot Therapeutics,囊获多款包含CT-388在内处于临床开发阶段的皮下和口服肠促胰岛素疗法。
此次公布的结果显示,经每周一次22 mg的CT-388皮下注射达24周后,患者体重平均降低幅度达18.8%且尚未达平台期,显示患者体重下降幅度仍有增加的可能。此外,100%接受CT-388治疗的受试者实现了超过5%的体重减轻,85%实现了超过10%,70%实现了超过15%,45%实现了超过20%的体重减轻。安全性方面,CT-388展现良好的耐受性,最常见的是轻度至中度胃肠道相关不良事件。罗氏计划在今年晚些时候启动CT-388的2期临床试验,旨在评估该药物的减重能力及其改善心血管疾病与2型糖尿病的潜力。
CT-996:公布1期临床试验数据
罗氏公布了其在研减重口服小分子CT-996于1期临床试验的积极结果。CT-996是一种每日一次、口服小分子GLP-1受体激动剂,正在开发用于治疗2型糖尿病和肥胖。与内源性GLP-1激素不同的是,CT-996被特别设计为一种具偏向性的GLP-1受体激动剂,即其可在激活cAMP信号转导的同时,最小化β-arrestin的募集。此偏向性有望产生较强的血糖控制、显著的体重减轻和良好的耐受性,为2型糖尿病和慢性体重管理的潜在”best-in-class“口服疗法。该疗法也是罗氏收购Carmot Therapeutics后囊获的多款肠促胰岛素疗法之一。
此次公布的结果显示,经过4周的用药,CT-996组患者体重减轻达7.3%,安慰剂组患者则减轻1.2%,两组差异具临床意义(差异值6.1%,p<0.001)。药代动力学数据支持CT-996每日一次口服给药方案。此外,研究结果还表明,在禁食期间或标准化高脂餐后,受试者血液中CT-996的水平未受到大幅影响。因此,CT-996的给药可能不需考虑进餐时间,故该药物具有潜在更大的给药灵活性。基于该研究数据,罗氏预计CT-996不仅可用于血糖控制和体重减轻的治疗,还可能作为患者在接受注射型减重疗法后的口服体重维持治疗。
CT-996的安全性和耐受性与其他口服GLP-1受体激动剂一致,大部分为轻度或中度胃肠道相关不良事件,未发生与研究药物相关的治疗中止事件。
RMC-6236:公布1b期临床试验数据
Revolution Medicines公司公布了其在研泛RAS抑制剂RMC-6236于1b期临床试验的积极结果。致癌RAS蛋白驱动高达30%的所有人类癌症,尤其是在PDAC、非小细胞肺癌(NSCLC)和结直肠癌(CRC)中最为显著。在人类癌症中,RAS G12突变(如G12D、G12V和G12C)为主要的RAS突变种类。RMC-6236是一款口服、可靶向突变和野生型RAS在GTP结合(具活性,ON)状态下的选择性抑制剂。该公司指出,RMC-6236是针对所有主要RAS突变型的首个靶向在研疗法。
此次公布的结果显示,RMC-6236单药作为二线疗法治疗带有KRAS G12X突变PDAC患者的中位无进展生存期(PFS)为8.1个月。过往试验显示,这类患者群体的中位PFS仅为2.0-3.5个月。在那些接受RMC-6236治疗至少20个月的KRAS G12X突变PDAC患者中,客观缓解率为27%,疾病控制率为87%。该公司已着手准备该药物作为PDAC患者二线疗法的全球性随机临床3期试验。
注:KRAS G12X指的是KRAS蛋白第12位的甘氨酸因为基因突变,转换成其它氨基酸。
DLQ01:公布1b/2a期临床试验数据
Dermaliq Therapeutics公司宣布,基于该公司新型hyliQ技术平台开发的外用前列腺素F2α类似物候选产品DLQ01在治疗雄激素性脱发男性患者的1b/2a期临床试验中获得了具有统计学意义的初步数据。DLQ01的作用方式是新颖的,涉及PEG2a受体的调节。hyliQ技术使毛囊能够有针对性地快速吸收DLQ01,从而实现有效、安全和耐受性良好的治疗。
此次公布的结果显示,与赋形剂相比,DLQ01治疗使患者的目标区域毛发计数(TAHC)比基线时增加了12.3%,具有统计学意义(p=0.008)。83%的受试者在头发生长方面出现了积极变化。相比之下,接受对照药物(米诺地尔)患者的TAHC比基线增加了9.8%。安全性方面,所有DLQ01治疗组的耐受性都很好,没有任何皮肤反应导致治疗中止或中断。
LX2006:公布1/2期临床试验的中期数据
Lexeo Therapeutics公司宣布了其用于治疗弗里德赖希共济失调(FA)心肌病的在研基因疗法LX2006的1/2期临床试验和另一项1a期试验的积极中期数据。LX2006以腺相关病毒(AAV)为载体,旨在通过静脉注射递送功能性FXN基因来促进FXN蛋白的表达,并恢复心肌细胞中的线粒体功能。在临床前研究中,LX2006逆转了FA疾病模型中的心脏异常,显示出心脏功能和生存率的改善,同时表现出良好的安全性。FDA已授予LX2006治疗FA心肌病的罕见儿科疾病资格、快速通道资格和孤儿药资格。
此次公布的结果显示,75%基线左心室质量指数(LVMI)升高的患者在12个月时实现了超过10%的LVMI减少(n=4),为11.4%。在所有患者中,50%在12个月时实现了超过10%的LVMI减少(n=6)。患者的心脏生物标志物改善幅度达53.3%,具有临床意义。LX2006在两项研究中均展现良好的耐受性,迄今为止没有与治疗相关的严重不良事件。根据此积极结果,Lexeo计
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..