7 月 22 日,信达生物宣布胰高血糖素样肽-1 受体(GLP-1R)/胰高血糖素受体(GCGR)双重激动剂玛仕度肽(研发代号:IBI362)在中国 2 型糖尿病受试者中开展的 III 期临床研究(DREAMS-1)达成首要终点和全部关键次要终点,展现出降糖、减重双达标及心血管肾脏代谢指标的综合获益。
此前,玛仕度肽头对头度拉糖肽治疗 2 型糖尿病的 III 期临床 DREAMS-2 也已达成研究终点,玛仕度肽展现出显著优效于度拉糖肽的降糖疗效,并在减重、心血管代谢指标均展示出了更优越的综合获益。信达生物计划于近期向 CDE 递交玛仕度肽治疗 2 型糖尿病的新药上市申请(NDA)。玛仕度肽首个减重适应症已于 2024 年初获 CDE 受理。
玛仕度肽研发历史时光轴
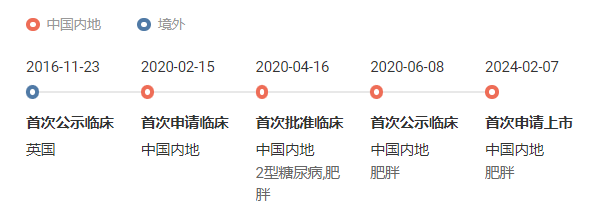
截图来自:Insight 数据库官网
玛仕度肽是信达生物与礼来共同推进的一款 GLP-1R/GCGR 双重激动剂。作为一种哺乳动物胃泌酸调节素(OXM)类似物,玛仕度肽除了通过激动 GLP-1R 促进胰岛素分泌、降低血糖和减轻体重外,还可通过激动 GCGR 增加能量消耗增强减重疗效,同时改善肝脏脂肪代谢。玛仕度肽已在多项临床研究中展现出优秀的减重和降糖疗效,以及降低腰围、血脂、血压、血尿酸、肝酶及肝脏脂肪含量,以及改善胰岛素敏感性,带来多重代谢获益。
2024 年 2 月,玛仕度肽的首个 NDA 获 NMPA 受理,用于成人肥胖或超重患者的长期体重控制。Insight 数据库预测,该适应症申请预计将于 2025 年第三季度获批。
玛仕度肽当前共开展了五项 III 期临床研究,包括:在中国超重或肥胖受试者中开展的 III 期临床研究(GLORY-1);在中重度肥胖的中国肥胖受试者中开展的 III 期临床研究(GLORY-2);在初治的中国 2 型糖尿病患者中开展的 III 期临床研究(DREAMS-1);在口服药物治疗血糖控制不佳的中国 2 型糖尿病受试者中开展的对比玛仕度肽和度拉糖肽的 III 期临床研究(DREAMS-2);在中国 2 型糖尿病合并肥胖的受试者中开展的对比玛仕度肽和司美格鲁肽的 III 期临床研究(DREAMS-3)。
本次达到终点的 DREAMS-1(NCT05628311)是一项随机、双盲、安慰剂对照的 III 期临床研究,旨在经单纯饮食、运动干预血糖控制不佳的中国 2 型糖尿病患者中评估玛仕度肽的有效性和安全性。研究纳入 320 例受试者(基线平均糖化血红蛋白(HbA1c)8.24%,平均体重 77.7 kg),按 1:1:1 比例随机分配至玛仕度肽 4 mg 组(N=106)、玛仕度肽 6 mg 组(N=106)或安慰剂组(N=108),双盲治疗 24 周。完成双盲治疗后,玛仕度肽 4 mg 组和 6 mg 组受试者分别继续接受玛仕度肽 4 mg 和 6 mg 治疗 24 周,安慰剂组受试者接受玛仕度肽 6 mg 治疗 24 周。研究的首要终点为第 24 周时玛仕度肽 4 mg 和 6 mg 在 HbA1c 相对基线的变化上优效于安慰剂。
有效性数据显示:
研究达到了首要终点。基于疗效估计目标,第 24 周时,玛仕度肽 4 mg 组和 6 mg 组 HbA1c 较基线平均降幅分别为 1.57% 和 2.15%,均优效于安慰剂组(0.14%)(P 值均<0.0001)。玛仕度肽组的 HbA1c 降幅疗效维持至第 48 周。
关键次要终点数据显示,玛仕度肽具有降糖、减重双重疗效优势。第 24 周时,玛仕度肽 4 m 和 6 mg 在体重较基线降幅、HbA1c 达标率、体重达标率以及 HbA1c 体重复合达标率*方面均显著优于安慰剂;治疗至第 48 周时,玛仕度肽 6 mg 组体重较基线降幅达 9.6%。
除 HbA1c 和体重外,玛仕度肽还降低餐后血糖、腰围、血压、血脂、转氨酶,以及尿白蛋白肌酐比等心血管及肾脏代谢指标。
此外,整体安全性与耐受性良好,与玛仕度肽既往临床研究结果一致。最常报告的不良事件是胃肠道不良事件,多为轻度或中度。无新增安全性风险。低血糖事件发生率较低,且绝大多数为 1 级低血糖(3.0 mmol/L≤血糖<3.9 mmol/L),无重度低血糖事件发生。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..