2024年优先审评,17款抗癌新药被纳入,来自辉瑞、默沙东、正大天晴、恒瑞等!
发布时间: 2024-07-16 来源: 药明康德
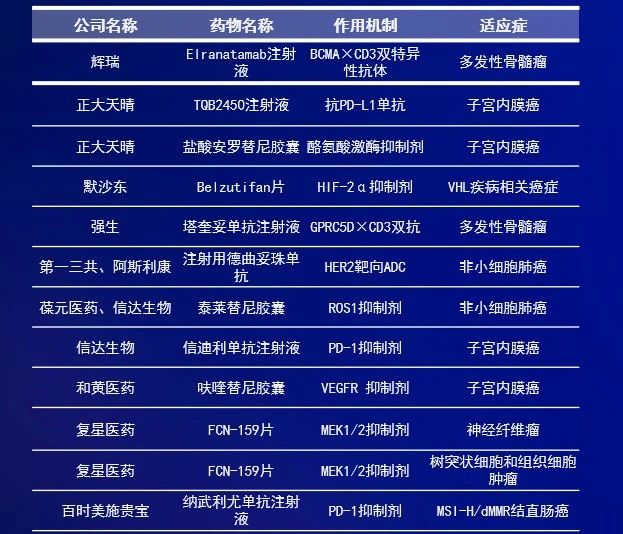
优先审评是中国国家药品监督管理局药品审评中心(CDE)推出的加速药物获批上市的重要政策之一。根据CDE发布的《2023年度药品审评报告》,获得优先审评审批的药物上市注册申请的审评时限由常规程序的200日缩短为130日,获批速度显著提升。根据CDE官网公示信息,截至6月27日,2024年上半年共计有26个创新药的上市申请正式被纳入优先审评。从治疗领域来看,抗肿瘤药物最多,有17个,占比超65%。本文中就让我们来看看这些抗肿瘤药物都有哪些?它们都有望惠及哪些癌症患者?数据来源:CDE官网,《医药观澜》梳理。本表仅统计正式被纳入优先审评的药物,不含拟纳入药品。统计截至日期:2024年6月27日2024年1月,辉瑞(Pfizer)公司的elranatamab注射液上市申请被CDE纳入优先审评,用于治疗既往接受过至少三种治疗的复发或难治性多发性骨髓瘤(MM)成人患者。Elranatamab是一款皮下注射BCMA×CD3双特异性抗体,其一端与骨髓瘤细胞上的BCMA相结合,另一端与T细胞表面的CD3受体结合,使它们结合在一起并激活T细胞杀死骨髓瘤细胞。该药已于2023年获FDA加速批准,用于治疗复发/难治性MM患者。2024年1月,正大天晴申报的TQB2450注射液和安罗替尼胶囊联合疗法的一项上市申请被CDE纳入优先审评,拟用于治疗既往接受过一、二线化疗方案治疗失败或不能耐受的非微卫星高度不稳定(非MSI-H)或非DNA错配修复缺陷(非dMMR)的复发性或转移性子宫内膜癌患者。贝莫苏拜单抗(TQB2450)是一款抗PD-L1人源化单克隆抗体,已于今年5月获批联合安罗替尼胶囊和依托泊苷及卡铂一线治疗广泛期小细胞肺癌。安罗替尼是一种新型小分子多靶点酪氨酸激酶抑制剂,此前已在中国获批用于治疗多种肿瘤适应症。2024年2月,默沙东(MSD)的belzutifan片上市申请被CDE纳入优先审评,拟用于治疗von Hippel-Lindau(VHL)病相关肾细胞癌、中枢神经系统血管母细胞瘤或胰腺神经内分泌肿瘤。VHL是一种罕见遗传疾病,它可异常激活癌症患者体内的缺氧诱导因子(HIF-2α)。Belzutifan是一款选择性新型口服HIF-2α抑制剂,此前已获FDA批准用于治疗VHL疾病相关癌症。2024年2月,强生(Johnson & Johnson)公司申报的塔奎妥单抗注射液被CDE纳入优先审评,单药治疗既往接受过至少三种治疗的复发或难治性多发性骨髓瘤成人患者。公开资料显示,塔奎妥单抗(talquetamab)是一款皮下注射双特异性抗体,靶向GPRC5D和CD3,已于2023年8月获美国FDA加速批准上市,用于治疗复发性或难治性多发性骨髓瘤成人患者。2024年2月,第一三共(Daiichi Sankyo)公司申报的注射用德曲妥珠单抗被CDE正式纳入优先审评,拟定适应症为:存在HER2(ERBB2)激活突变且既往接受过至少一种系统治疗的不可切除或转移性成人NSCLC患者。德曲妥珠单抗是阿斯利康(AstraZeneca)和第一三共联合开发的一款靶向HER2的抗体偶联药物(ADC),此前已在中国获批治疗HER2阳性和HER2低表达成人乳腺癌患者。2024年2月,葆元医药(现已被Nuvation Bio收购)申报的泰莱替尼胶囊上市申请被CDE纳入优先审评,用于未经ROS1-TKI治疗的ROS1阳性局部晚期或转移性NSCLC成人患者的治疗。泰莱替尼是新一代口服选择性ROS1抑制剂,具有脑渗透潜力。2021年6月,葆元与信达生物签订了独家许可协议,在大中华区(包括中国大陆、香港、澳门和台湾地区)共同开发和商业化泰莱替尼。2024年3月,信达生物的PD-1抑制剂信迪利单抗与和黄医药的VEGFR抑制剂呋喹替尼的联合疗法上市申请被CDE纳入优先审评,拟用于既往系统性抗肿瘤治疗后疾病进展且不适合进行根治性手术治疗或根治性放疗的晚期pMMR或non MSI-H子宫内膜癌患者。公开资料显示,信达生物与和黄医药曾在2018年达成合作,开展信迪利单抗与呋喹替尼用于实体瘤联合治疗的研究。2024年4月,复星医药的FCN-159片(复迈替尼)上市申请被CDE纳入优先审评,拟用于治疗成人树突状细胞和组织细胞肿瘤。2024年5月,FCN-159片的新适应症上市申请再次被CDE纳入优先审评,用于治疗2岁及2岁以上儿童1型神经纤维瘤病(NF1)相关的丛状神经纤维瘤。FCN-159为一款MEK1/2选择性抑制剂,可以抑制RAS通路异常引起的肿瘤增殖,拟开发主要用于治疗晚期实体瘤、I型神经纤维瘤、树突状细胞和组织细胞肿瘤、低级别脑胶质瘤等适应症。