转自:CDE 排版:水晶
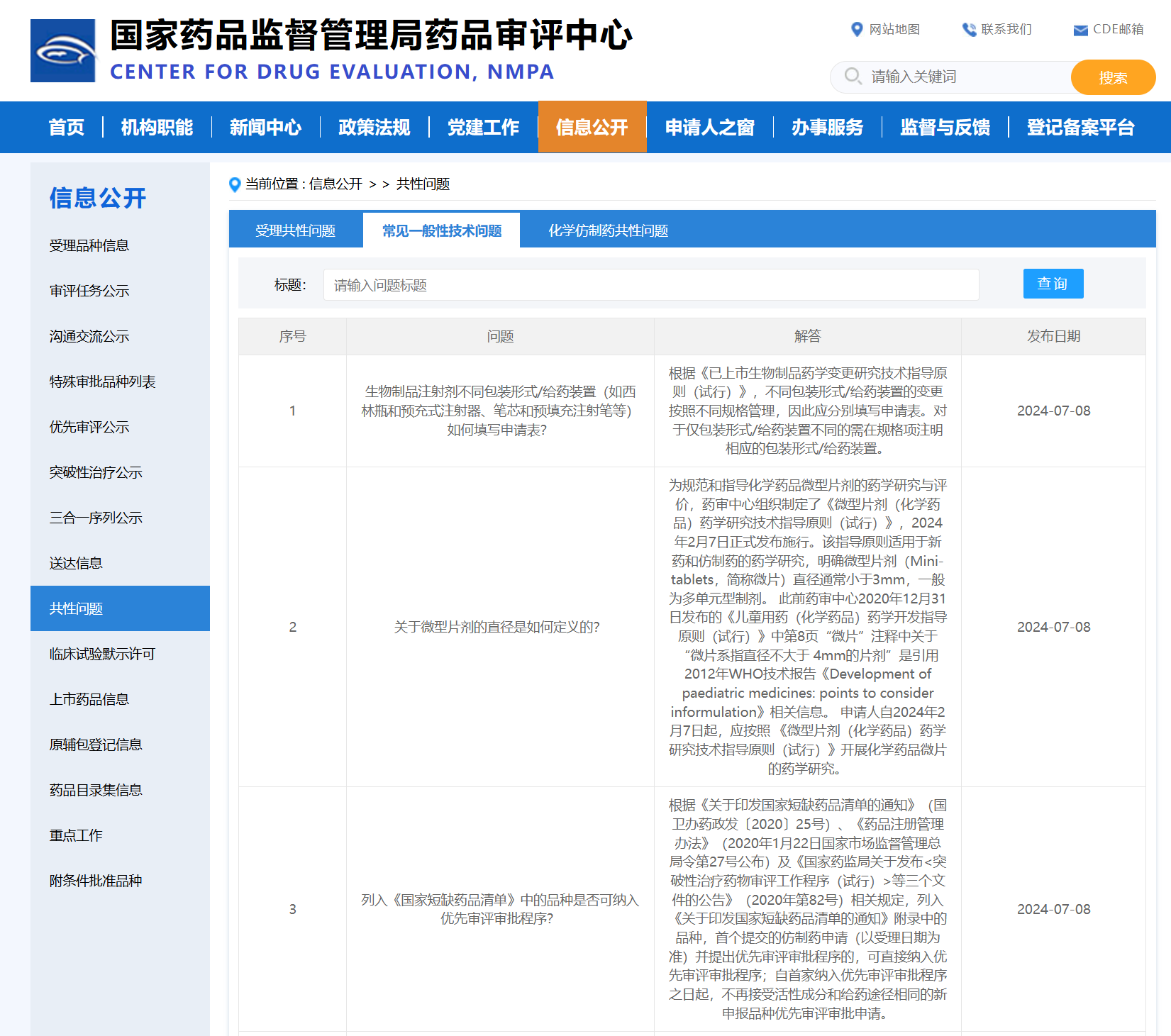
Q1、生物制品注射剂不同包装形式/给药装置(如西林瓶和预充式注射器、笔芯和预填充注射笔等)如何填写申请表?
A1、根据《已上市生物制品药学变更研究技术指导原则(试行)》,不同包装形式/给药装置的变更按照不同规格管理,因此应分别填写申请表。对于仅包装形式/给药装置不同的需在规格项注明相应的包装形式/给药装置。
Q2、关于微型片剂的直径是如何定义的?
A2、为规范和指导化学药品微型片剂的药学研究与评价,药审中心组织制定了《微型片剂(化学药品)药学研究技术指导原则(试行)》,2024年2月7日正式发布施行。该指导原则适用于新药和仿制药的药学研究,明确微型片剂(Mini-tablets,简称微片)直径通常小于3mm,一般为多单元型制剂。
此前药审中心2020年12月31日发布的《儿童用药(化学药品)药学开发指导原则(试行)》中第8页“微片”注释中关于“微片系指直径不大于4mm的片剂”是引用2012年WHO技术报告《Development of paediatric medicines :points to consider informulation》相关信息。申请人自2024年2月7日起,应按照《微型片剂(化学药品)药学研究技术指导原则(试行)》开展化学药品微片的药学研究。
Q3、列入《国家短缺药品清单》中的品种是否可纳入优先审评审批程序?
A3、根据《关于印发国家短缺药品清单的通知》(国卫办药政发〔2020〕25号)、《药品注册管理办法》(2020年1月22日国家市场监督管理总局令第27号公布)及《国家药监局关于发布<突破性治疗药物审评工作程序(试行)>等三个文件的公告》(2020年第82号)相关规定,列入《关于印发国家短缺药品清单的通知》附录中的品种,首个提交的仿制药申请(以受理日期为准)并提出优先审评审批程序的,可直接纳入优先审评审批程序;自首家纳入优先审评审批程序之日起,不再接受活性成分和给药途径相同的新申报品种优先审评审批申请。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..