据 Insight 数据库统计,上周(6 月 23 日—6 月 29 日)全球共有 48 款创新药(含改良新)研发进度推进到了新阶段,其中 7 款获批上市,3 款申报上市,17 款获批临床,8 款申报临床。
下文,Insight 将分别摘取国内外部分重点项目做介绍。
国内创新药进展
2024 年度的医保目录调整工作已经开始,能够获得准入谈判资格的创新药获批时间正是截止在 6 月 30 日。因此毫无意外,在「关门」前最后一周,上周也成为了新药获批井喷的一周,无数新药踩线呼啸而过、冲刺成功。
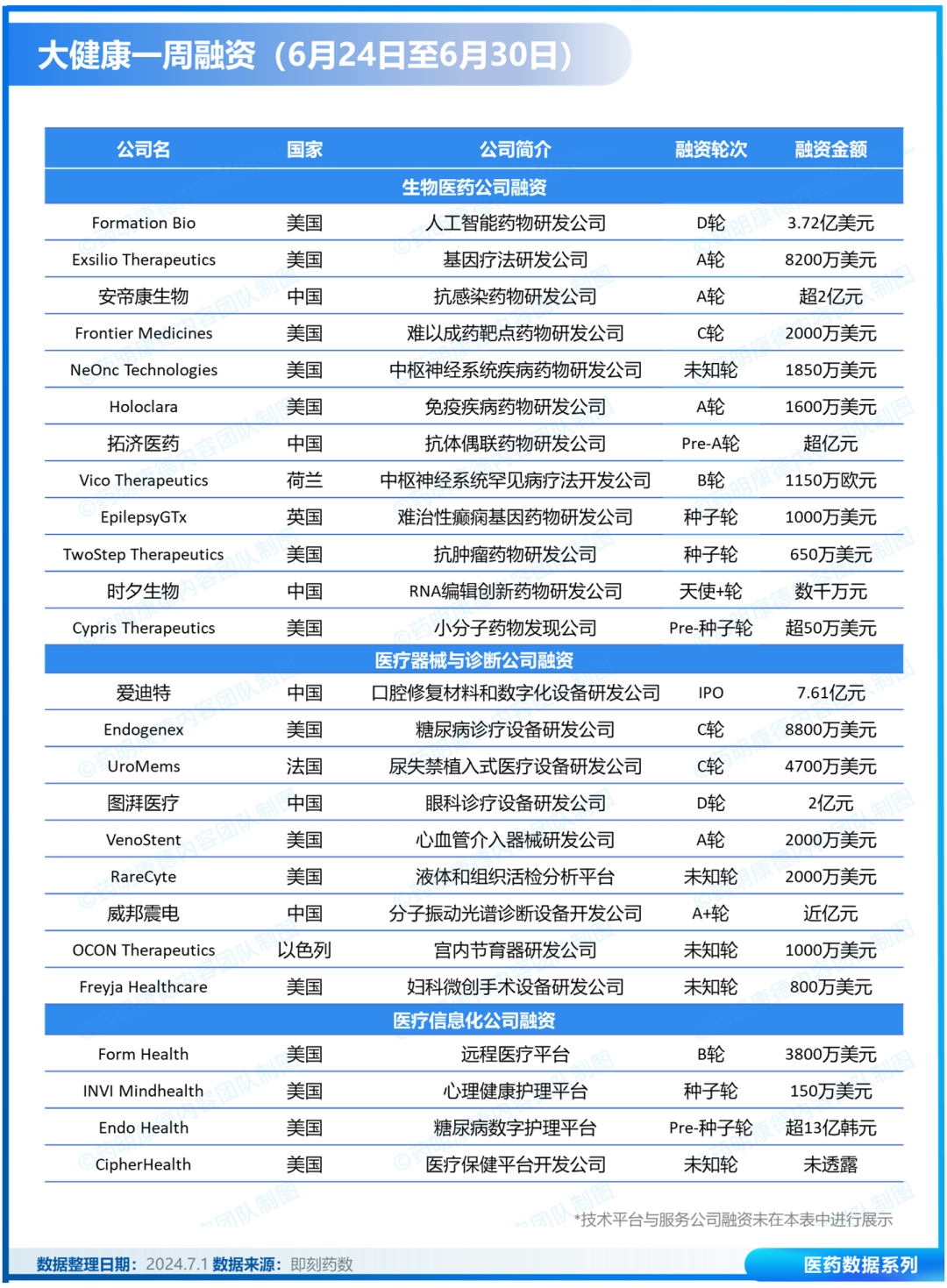
从新药首次获批的角度看,强生的第 4 款多发性骨髓瘤新药、CD3/BCMA 双抗「特立妥单抗」;百奥泰的 1 类新药「倍维巴肽」;海思科的 DPP4 抑制剂「考格列汀」;石药的 PD-1 单抗「恩朗苏拜单抗」……都在本周获批上市。当然,诺和诺德的两款周制剂「依柯胰岛素」和「司美格鲁肽」减重版更是重磅炸弹级别。
从新适应症获批的角度,本周君实的 PD-1 单抗、百济的 PD-1 单抗、默沙东的 PD-1单抗、阿斯利康的三代 EGFR-TKI、恒瑞的 SGLT2 抑制剂……都有新适应症获批上市。
因此,本周的 Insight 新药周报将主要摘取获批资讯进行介绍。
除此之外,本周国内还有 15 款新药获批临床,7 款申报临床。
进口新药首次获批上市
1、强生制药:CD3/BCMA 双抗在华首次获批
6 月 25 日,强生制药宣布,旗下创新治疗药物泰立珂®(特立妥单抗注射液)正式获得 NMPA 批准,单药适用于既往至少接受过三线治疗(包括一种蛋白酶体抑制剂、一种免疫调节剂和一种抗 CD38 单克隆抗体)的复发或难治性多发性骨髓瘤(RRMM)成人患者。
泰立珂®是首个被批准用于治疗 RRMM、靶向 B 细胞成熟抗原(BCMA)和 CD3 的双特异性抗体,此前已于美国和欧盟等国家或地区获批上市。
这是一款全球首创、即用型、基于体重给药的皮下注射双特异性抗体,可将 CD3+T 细胞重定向到表达 BCMA 的骨髓瘤细胞,以诱导杀伤肿瘤细胞。经临床验证,泰立珂®在既往至少接受过三线治疗的复发或难治性多发性骨髓瘤患者中的缓解率高,中国患者获益更佳,总缓解率(ORR)达 76.9%。
泰立珂®是强生在中国获批的第四个用于治疗多发性骨髓瘤的产品,进一步丰富了其在多发性骨髓瘤和血液肿瘤治疗领域领先的产品组合,让更多患者能够有机会实现功能性治愈。
国产新药首次获批上市
1、石药集团:PD-1 单抗获批上市
6 月 28 日,NMPA 官网显示,石药集团开发的恩朗苏拜单抗注射液(商品名:恩舒幸)获批上市,用于治疗至少一线含铂方案化疗失败的 PD-L1 阳性的复发或转移性宫颈癌患者。
恩朗苏拜单抗是一款全人源、高亲和力的抗 PD-1 IgG4 单克隆抗体,通过早期的 Ib 期研究已证实其在 PD-L1 阳性复发或转移性宫颈癌患者中具有良好的疗效。在 ASCO 2024 大会上公布的 II 期研究(NCT04886700)进一步验证了其安全性和有效性。
该 II 期研究共纳入 107 名 PD-L1 阳性(CPS≥1)的宫颈癌患者,她们在接受一线铂类治疗期间或之后出现了疾病进展或对一线铂类治疗不耐受。患者每两周接受一次 240 mg 的恩朗苏拜单抗治疗,治疗周期最长为 24 个月,直至出现疾病进展、不可耐受的毒性或其他研究终止标准。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..