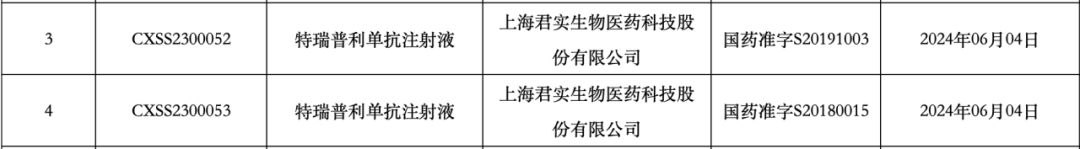
6 月 12 日,据 NMPA 官网消息,君实生物特瑞普利单抗注射液第 9 项适应症正式获批上市,将与依托泊苷和铂类联合用于广泛期小细胞肺癌(ES-SCLC)的一线治疗。
截图来自:NMPA 官网
特瑞普利单抗注射液是我国批准上市的首个国产以 PD-1 为靶点的单抗药物。它通过封闭 T 淋巴细胞上的 PD-1 受体,阻断其与肿瘤细胞表面的 PD-L1 结合,进而解除肿瘤细胞对免疫细胞的抑制,使免疫细胞重新发挥抗肿瘤作用,来有效杀伤肿瘤细胞。
此前,该药物已获批八项适应症。最近一次是在 4 月 7 日,NMPA 批准特瑞普利单抗注射液联合阿昔替尼用于中高危不可切除或转移性肾细胞癌患者的一线治疗。由此可见,特瑞普利单抗注射液在癌症治疗领域正呈现出「全面开花」态势。
本次新适应症获批上市主要源于 III 期 EXTENTORCH 研究(NCT04012606)结果。这项在全国 51 家中心展开的随机、双盲、安慰剂对照、多中心临床试验旨在比较特瑞普利单抗或安慰剂联合依托泊苷及铂类一线治疗 ES-SCLC 的有效性和安全性。
在这项研究中,患者按 1:1 比例随机分配,然后接受特瑞普利单抗或安慰剂联合依托泊苷及铂类的治疗,直至出现疾病进展、不可耐受的毒性或方案规定的其他需要终止治疗的情况。
结果表明,相比单纯化疗,特瑞普利单抗联合化疗一线治疗 ES-SCLC 可显著延长患者的 PFS 和 OS。数据显示,特瑞普利单抗组的中位 PFS 达 5.8 个月,疾病进展或死亡风险降低 33.3%(P=0.0002),1 年 PFS 率较化疗组提升近 4 倍(18.1% vs. 4.9%)。另外,特瑞普利单抗组的中位 OS 达 14.6 个月,死亡风险降低 20.2%(P=0.0327),1 年 OS 率高达 63.1%。
在安全性方面,特瑞普利单抗安全性数据与既往研究相似,没有出现新的安全性信号。
除了在国内取得显著成就外,特瑞普利单抗还成功「出海」,布局国际化道路。据君实生物官网介绍,2022 年 12 月和 2023 年 2 月,EMA 和 MHRA 分别受理特瑞普利单抗联合顺铂和吉西他滨用于局部复发或转移性鼻咽癌患者的一线治疗以及联合紫杉醇和顺铂用于不可切除局部晚期/复发或转移性食管鳞癌患者的一线治疗的上市许可申请。
2023 年 11 月,TGA 受理了特瑞普利单抗联合顺铂/吉西他滨作为转移性或复发性局部晚期鼻咽癌成人患者的一线治疗,以及作为单药治疗既往含铂治疗过程中或治疗后疾病进展的复发性、不可切除或转移性鼻咽癌的成人患者的上市许可申请,特瑞普利单抗治疗鼻咽癌获得 TGA 授予孤儿药资格认定。
此外,特瑞普利单抗已作为首款鼻咽癌药物在美国获得批准,其在黏膜黑色素瘤、鼻咽癌、软组织肉瘤、食管癌、小细胞肺癌领域获得 FDA 授予的 2 项突破性疗法认定、1 项快速通道认定、1 项优先审评认定和 5 项孤儿药资格认定。
综上所述,特瑞普利单抗不仅在国内展现出良好的临床疗效和安全性,还成功打进国际市场,进一步巩固了其在全球肿瘤治疗领域的重要地位。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..