据 Insight 数据库统计,6 月 2 日—6 月 8 日全球共有 65 款创新药(含改良新)研发进度推进到了新阶段,其中 2 款获批上市,4 款申报上市,9 款获批临床,6 款申报临床。
下文,Insight 将分别摘取国内外部分重点项目做介绍。
国内创新药进展
国内部分,本周共有 50 款创新药(含改良新)研发进度推进到了新阶段,其中 1 款获批上市,3 款申报上市,8 款获批临床,9 款申报临床。
本周国内首次启动临床的 14 款创新药(含改良新)

来自:Insight 数据库网页版
申报上市
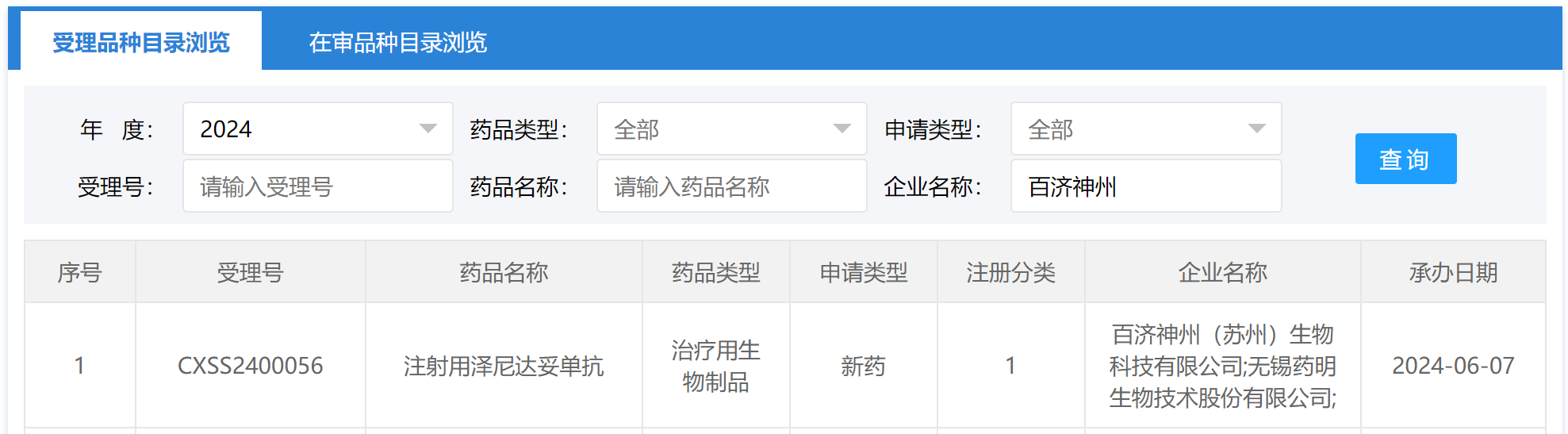
1、百济神州:国内首款 HER2 双抗报上市
6 月 7 日,据 CDE 官网显示,百济神州的 HER2 双特异性抗体「注射用泽尼达妥单抗」上市申请已获 CDE 受理(受理号:CXSS2400056)。
这是国内申报上市的首款 HER2 双抗,早前已于 23 年 11 月被 CDE 纳入优先审评,用于既往接受过全身治疗的 HER2 高表达的不可切除局部晚期或转移性胆道癌患者。
截图来自:CDE 官网
泽尼达妥单抗(Zanidatamab/ZW25)是百济从 Zymeworks 公司引进的一款 HER2 双抗,可以同时结合两个非重叠的 HER2 表位(亚基 2 和亚基 4),即双互补位结合。
在 2023 ASCO 年会上公布了关键性 IIb 期 HERIZON-BTC-01 研究结果,治疗既往经治的 HER2 扩增型胆管癌。
该研究共纳入了 87 名受试者。这些受试者中 54% 为女性,66% 为亚洲人;52% 患有胆囊癌,30% 患有肝内胆管癌,18% 患有肝外胆管癌。试验主要终点是 HER2 阳性队列通过独立中心审查(ICR)确认的 cORR,次要终点包括其他疗效和安全性结果。
研究结果显示,在 HER2 阳性患者中,cORR 为 41%,中位 DOR 为 12.9 个月;中位研究随访时间为 12.4 个月。截止 2022 年 10 月 10 日,在 33 名应答者中,49% 有持续应答,82% 的 DOR ≥ 16 周。首次应答的中位时间为 1.8 个月。研究人员正在评估患者无进展生存率和总生存率。
安全性方面,72% 的患者发生了治疗相关不良事件(TRAE)。18% 的患者发生 3 级 TRAEs;两名患者因不良事件而停用泽尼达妥单抗。7 名患者有严重 TRAE。
2、罗氏制药:PI3Kα 抑制剂「伊那利塞」国内报上市
6 月 3 日,CDE 官网显示,罗氏的 PI3Kα 抑制剂「伊那利塞片」上市申请获受理(受理号:JXHS2400037/8)。
伊那利塞(inavolisib)研发代号为 GDC-0077,今年 4 月就已经被 CDE 纳入优先审评,与哌柏西利和内分泌疗法联合用药适用于治疗 PIK3CA 突变、激素受体(HR)阳性、人表皮生长因子受体 2(HER2)阴性、局部晚期或转移性乳腺癌成人患者。
PIK3CA 突变率约 40%,在乳腺癌患者较常见但常常被忽视。
Inavolisib 是一种创新口服靶向治疗药物,对 PI3Kα 的抑制有高效力和特异性,同时有独特的作用机制可降解 PI3Kα 突变体,能为 HR 阳性、PIK3CA 突变的乳腺癌患者提供良好的耐受性、持久的疾病控制并有可能改善预后。
去年 12 月,罗氏宣布 III 期临床试验 INAVO120 研究取得阳性结果。
该研究旨在评价 Inavolisib 联合哌柏西利和氟维司群在 PIK3CA 突变、HR 阳性、HER2 阴性局部晚期或转移性乳腺癌患者的有效性和安全性,共入组 325 例在辅助内分泌治疗期间或治疗完成后 12 个月内发生疾病进展,且既往针对转移性疾病未接受过系统治疗的患者。主要终点是研究者评估的无进展生存期。次要终点包括总生存期、客观缓解率和临床获益率。
结果显示,与哌柏西利和氟维司群的对照组相比,Inavolisib 联合哌柏西利和氟维司群治疗组将疾病进展或死亡风险降低了 57%,中位 PFS 为 15.0 个月 VS 7.3 个月。虽然 OS 数据尚不成熟,但已观察到明显的积极趋势。安全性方面,Inavolisib 联合治疗耐受性良好,不良反应与已知安全性特征一致,未观察到新的安全信号。
今年 5 月 29 日,罗氏刚刚宣布 Inavolisib 在美国的上市申请也获得优先审评资格,PDUFA 日期为 2024 年 11 月 27 日。
3、复星医药:MEK1/2 抑制剂「复迈替尼」申报新适应症
6 月 6 日,CDE 官网显示,复星医药的 MEK1/2 抑制剂复迈替尼片(FCN-159)上市申请获受理(受理号:CXHS2400048/9)。
这是复迈替尼申报上市的第 2 项适应症。就在不久前的 5 月 23 日,复迈替尼的首个上市申请刚刚被 CDE 受理,首报上市适应症为成人树突状细胞和组织细胞肿瘤,已纳入优先审评。而本次申报的适应症推测为 1 型神经纤维瘤(NF1)相关丛状神经纤维瘤(PN),此前也在 2023 年 7 月被纳入突破性疗法。
从适应症来看,复迈替尼可以说是「多边形战士」了。该药用于治疗儿童 NF1、儿童朗格汉斯细胞组织细胞增生症、低级别脑胶质瘤、动静脉畸形的适应症目前都处于 II 期临床试验阶段,用于治疗实体瘤的适应症处于 I 期临床试验阶段。
临床数据显示,约 20%~50% 的 1 型神经纤维瘤(NF1)患者会出现丛状神经纤维瘤(PN)。由于 NF1 相关 PN 的复杂性及其侵袭性生长方式,手术治疗存在较高风险和难度。部分肿瘤位于头部、颈部、脊椎等特殊部位,无法完全切除,且复发率较高。因此,NF1 相关 PN 的手术治疗效果有限,仍需要新的疗法。
复迈替尼是复星医药自主研发的高活性、高选择性 MEK1/2 抑制剂。刚刚召开的的 ASCO 年会上,复迈替尼在 NF1 儿童患者中开展的 Ⅱ 期试验结果以海报形式进行了展示。
该试验评估了 43 名患者的疗效数据,截至 2023 年 11 月 24 日,中位随访时间为 15.1 个月,研究者评估的最佳 ORR 和确认的 ORR 分别为 69.8% 和 48.8%,而由 BIRC 评估的最佳 ORR 和确认的 ORR 分别为 48.8% 和 30.2%。在安全性方面,复迈替尼耐受性良好,并表现出显著的抗肿瘤活性。
另外,复迈替尼针对 NF1 相关 PN 成人的 Ⅰ 期临床研究数据显示,在 19 名患者中,复迈替尼耐受性良好,不良事件可控,并显示出有希望的抗肿瘤活性。此外,复迈替尼在存在症状且无法手术的 NF1 相关 PN 成人患者中进行的 III 期临床研究也在 2023 年 6 月进行了公示。
4、康诺亚:司普奇拜单抗第 3 项适应症报上市
6 月 7 日,康诺亚宣布,该公司自主研发的 1 类新药司普奇拜单抗注射液(CM310)治疗慢性鼻窦炎伴鼻息肉的药品上市许可申请已获国家药品监督管理局受理,并被纳入优先审评审批程序。这是司普奇拜单抗在中国的第 3 项适应症药品上市申请。
此次申报是基于一项多中心、随机、双盲、安慰剂对照的 III 期临床研究,旨在评估司普奇拜单抗在治疗慢性鼻窦炎伴鼻息肉患者中的有效性及安全性。
研究显示,III 期临床数据结果积极,达到共同主要终点,司普奇拜单抗组皆优于安慰剂组,具备高度显著的统计学差异,且安全性良好。接受司普奇拜单抗治疗后,鼻息肉能够快速显著缩小,鼻堵症状缓解,嗅觉得到有效改善,且 6 个月以上的长期治疗能带来持续的临床获益,几乎达到临床治愈,全面改善患者生活质量。
司普奇拜单抗是国内首个具有自主知识产权的新型人源化 IL-4Rα单抗,是国内首个、全球范围第二个申报上市的 IL-4Rα靶点药物。通过靶向 IL-4Rα,司普奇拜单抗可双重阻断白介素 4(IL-4)及白介素 13(IL-13)的信号传导。IL-4 及 IL-13 为引发 2 型炎症的两种关键细胞因子。
近期,其多个适应症开发取得重大进展:
成人中重度特应性皮炎适应症:III 期临床研究长期疗效及安全性数据于近期发布,52 周数据显示其可强效持续改善皮损,治疗 52 周的 EASI-75 改善达标率超过 90%,EASI-90 达标率接近 80%,目前该适应症的上市申请正在优先审评审批程序中;
慢性鼻窦炎伴鼻息肉适应症:药品上市许可申请获受理,并被纳入优先审评审批程序,其 II 期研究成果获北京市科学技术进步奖一等奖;
季节性过敏性鼻炎适应症的药品上市许可申请已获受理,治疗青少年中重度特应性皮炎的 III 期临床研究等多个适应症临床研究快速推进。
5、艾伯维:IL-23 单抗「利生奇珠单抗」国内申报新适应症
6 月 4 日,据 CDE 官网显示,艾伯维利生奇珠单抗(Risankizumab)注射液以及皮下注射制剂的新适应症国内申报上市(受理号:JXSS2400046/7)。
Risankizumab 是一款 IL-23 单抗,可通过与 IL-23 p19 亚基结合来选择性阻断 IL-23。
据 Insight 数据库显示,Risankizumab 最早于 2019 年 3 月在日本获批上市,此后又先后获得 FDA、EMA 批准上市。据 Insight 数据库显示当前已在日本获批 6 项适应症。在美国也已获批斑块状银屑病、银屑病关节炎以及克罗恩病。
自上市以来,Risankizumab 销售额一路猛涨,2023 销售额同比增长超 50%,已达到 77.63 亿美元,2024 年有望突破百亿美元。
在国内,于 2017 年 4 月首次启动临床,针对克罗恩病。当前已登记启动 5 项 III 期临床试验,分别针对克罗恩病和溃疡性结肠炎。去年 7 月,利生奇珠单抗首次在国内申请上市获受理,适应症推测为克罗恩病,当前正在审评中(JXSS2300051)。此次申报新适应症,推测为溃疡性结肠炎。
艾伯维已在去年 8 月向 FDA 和 EMA 递交了该适应症的上市申请,有望在今年获批上市。该申请是基于 INSPIRE 与 COMMAND 两项研究的积极结果。
拟优先审评
1、诺诚健华:CD19 单抗拟纳入优先审评,治疗 DLBCL
6 月 3 日,根据 CDE 官网公示,诺诚健华的 CD19 单抗「注射用坦昔妥单抗」(Tafasitamab)拟纳入优先审评,联合来那度胺用于治疗复发或难治性且不适合自体干细胞移植(ASCT)的弥漫性大 B 细胞淋巴瘤(DLBCL)成人患者。
Tafasitamab 是一种靶向 CD19 的人源化单克隆抗体,其包含独有的工程化 Fc 结构域,因此强化了抗体依赖性细胞介导的细胞毒作用(ADCC)和抗体依赖性细胞吞噬作用(ADCP),通过细胞凋亡和免疫效应机制介导 B 细胞肿瘤的裂解。
2020 年 7 月和 2021 年 8 月,Tafasitamab 分别获得 FDA 以及 EMA 有条件批准与来那度胺联合治疗不适合 ASCT 的复发/难治性 DLBCL 患者。
2023 年 11 月,Tafasitamab 纳入 2024 年度「北京普惠健康保」海外特药目录保障范围,以惠及 DLBCL 患者。据诺诚健华官网显示,Tafasitamab 已经纳入了中国 30 多个省市的海外特药医保目录。
2024 年 1 月,Tafasitamab 联合来那度胺获得广东省药品监督管理局批准,在大湾区用于治疗不适合 ASCT 的复发/难治性 DLBCL 成人患者。
临床试验方面,2023 年美国癌症研究协会(AACR)年会上公布了 2 期研究 L-MIND 的最终五年随访数据,为我们展示了复发/难治性 DLBCL 患者接受 Tafasitamab 联合来那度胺治疗的长期疗效和安全性。
在对截至 2022 年 11 月 14 日的所有数据分析后,研究发现患者的 ORR 为 57.5%,其中 CR 为 41.2%,PR 为 16.2%。另外,中位随访期为 44 个月,中位 DOR 尚未达到。中位总生存期为 33.5 个月,中位无进展生存期为 11.6 个月。
在随访时间超过 60 个月的 21 名患者中,14 名患者接受过一次前线治疗,7 名患者接受过两次以上的前线治疗。对于接受过一次前线治疗的 40 名患者,其 ORR 更高,达到 67.5%(包括 CR 率 52.5% 和 PR 率 15%)。研究没有发现新的安全事件,在联合治疗和单药治疗期间,大多数 AE 均为 1 级或 2 级。
新公布的五年 L-MIND 数据验证了 Tafasitamab 联合来那度胺有潜力为某些复发/难治性 DLBCL 患者提供长期有效的缓解。另外,此联合用药方案治疗复发/难治性 DLBCL 已获得中国临床肿瘤学会(CSCO)临床诊疗指南推荐,再次表明该策略的可行性。
目前,Tafasitamab 联合来那度胺治疗复发/难治性 DLBCL 患者的 II 期临床研究在中国已经完成患者入组(登记号:CTR20221519)。此外,一项评估 Tafasitamab 和来那度胺联合吉西他滨和奥沙利铂对比利妥昔单抗联合吉西他滨和奥沙利铂治疗复发/难治性 DLBCL 患者的有效性和安全性的随机、多中心、III 期临床研究也于今年 4 月进行了公示(登记号:CTR20241368)。
启动临床试验
1、诺和诺德:司美格鲁肽复方制剂 CagriSema 国内启动新 III 期临床
6 月 5 日,诺和诺德司美格鲁肽复方制剂 CagriSema 国内公示启动新 III 期临床 REIMAGINE 3 研究,旨在评估每周一次皮下注射 CagriSema 对比安慰剂在接受每日一次基础胰岛素伴或不伴二甲双胍治疗的 2 型糖尿病患者的疗效和安全性(登记号:CTR20241846)。
该研究在今年 3 月已在 ClinicalTrials.gov 上登记启动(登记号:NCT06323161),且在 3 月 26 日已完成全球首例受试者的入组工作。本次启动的是国内部分。
CagriSema 是司美格鲁肽与长效 Amylin(胰淀素)类似物 Cagrilintide 组成的一款复方药物。据 Insight 数据库显示,CagriSema 于 2022 年 6 月首次在国内申报临床,同年 8 月首次获批临床,并于去年 7 月首次启动临床。
针对 2 型糖尿病,国内已于去年启动一项 III 期 REIMAGINE 2 研究(登记号:CTR20240080),评估 CagriSema 对比司美格鲁肽在二甲双胍(伴或不伴 SGLT2 抑制剂)治疗的 2 型糖尿病患者中的疗效,今年 3 月完成了首例受试者的入组工作。
此前诺和诺德已在美国完成了一项治疗 2 型糖尿病的 II 期临床试验(登记号:NCT04982575),披露的数据结果表明,CagriSema 降糖和减重效果优于司美格鲁肽。CagriSema 组受试者平均 HbA1c 较基线降低 -2.18%,且患者平均体重减轻了 15.6%,效果显著优于司美格鲁肽单药的 -1.79% 以及 -5.1%。
从全球来看,据 Insight 数据库显示,CagriSema 已在全球登记启动了 10 项 III 期临床试验,包括 3 项降糖以及 7 项减重。诺和诺德还计划探索在包括 OSA 等在内的更多代谢疾病领域的治疗潜力,当前已启动了分别针对 MASH 以及 CKD 的 II 期临床研究。
2、齐鲁制药:CD3/CLDN18.2 双抗启动 II 期临床
6 月 6 日,据 ClinicalTrials.gov 官网显示,齐鲁登记启动了一项 II 期临床试验,评估 CD3/CLDN18.2 双抗 QLS31905 和/或 QL1706 联合化疗治疗 CLDN18.2 阳性晚期实体瘤的疗效(登记号:NCT06446388)。
QLS31905 是齐鲁自研的一款 1 类新药。据 Insight 数据库显示,当前全球共有 18 款 CD3/CLDN18.2 双抗在研,其中进入临床的仅 6 款,涉及的中国企业有 5 家,而齐鲁就是其中之一,与信达、百济等同台竞技。
获批临床
1、华东医药:1 类新药 ROR1 ADC 获批临床
6 月 4 日,华东医药宣布,其在研 1 类新药 HDM2005 获批临床,适应症为晚期恶性肿瘤。
注射用 HDM2005 是一款靶向受体酪氨酸激酶样孤儿受体 1(ROR1)的 ADC 新药。临床前研究显示,HDM2005 进入体内后,抗体部分与表达肿瘤抗原的靶细胞特异性结合,HDM2005 被肿瘤细胞内吞后,细胞毒素在胞内释放,从而完成对肿瘤细胞的杀伤;现有数据显示 HDM2005 具有良好的成药性和安全性。
2024 年 3 月,中美华东向 CDE 递交 HDM2005 的临床试验申请获受理,并于近日获得 NMPA 批准。
据 Insight 数据库显示,当前另有 16 款靶向 ROR1 在研,进入临床的除 HDM2005 外,仅 3 款。进展最快的是默沙东的 Zilovertamab Vedotin,已进入 II/III 期临床阶段。
境外创新药进展
境外部分,本周共有 18 款创新药(含改良新)研发进度推进到了新阶段,其中 2 款获批上市,4 款获批临床。
获批上市
1、Geron:全球首款端粒酶抑制剂「伊美司他」获 FDA 批准上市
6 月 6 日,Geron 公司宣布,其 first-in-class 端粒酶抑制剂伊美司他(imetelstat)已获 FDA 批准上市,商品名为 Rytelo,用于低风险至中等-1 风险的骨髓增生异常综合征(MDS)成年患者,这些患者患有输血依赖性贫血,需要 8 周内输入 4 个或更多的红细胞单位,且不适用红细胞生成刺激剂(ESAs)或对其无应答或产生耐药。
本次 Rytelo 获得批准主要基于 III 期临床试验 IMerge 的积极结果,其数据如下:
端粒是染色体末端的保护帽,每次细胞分裂时都会自然缩短。Rytelo 通过抑制端粒酶活性,可以抑制癌变干细胞和祖细胞不可控制的增殖,导致癌变细胞的凋亡,具有改变疾病进程的活性。
Geron 公司曾在 2014 年与 GSK 达成合作共同开发这款药物,不过在 2018 年,GSK 终止了这项交易。
医药交易
Insight 数据库显示,本周共有 21 项医药交易发生,其中包括 10 项授权/许可类合作、4 项转让/收购类合作。此处将精选本周部分医药交易进行介绍。
1、超 6 亿美元!康宁杰瑞与 Arrivent 合作开发 ADC 新药
6 月 5 日,康宁杰瑞宣布,与 ArriVent BioPharma, Inc. 订立研究与合作协议。
根据合作协议的条款,康宁杰瑞将与 ArriVent 合作,使用康宁杰瑞专有的连接子载荷平台 (Alphatecan) 及糖基定点偶联平台,以发现及开发 ADC 新药。
康宁杰瑞将保留在中国内地、香港特别行政区、澳门特别行政区及台湾地区(大中华区)开发及商业化合作协议中相关 ADC 产品的权利。在大中华区以外的国家和地区,ArriVent 将拥有相关 ADC 产品于肿瘤领域的开发及商业化的独家权利,并将负责及承担 ADC 产品的相应开发费用支出。
根据合作协议,康宁杰瑞有权收取一次性、不可退还的预付款以及潜在里程碑付
款,包括产品注册、开发及销售里程碑款项,总计高达 615.5 百万美元。此外,康宁杰瑞亦有权就各 ADC 产品向 ArriVent 收取分级销售特许权使用费。
2、趁胜追击!Summit 公司扩大与康方生物的合作
6 月 3 日,康方生物宣布,公司与 Summit Therapeutics(简称 Summit)签署了补充许可协议,在双方原有关于 PD-1/VEGF 双特异性抗体依沃西的合作许可协议下,拓展依沃西的许可市场范围。
根据补充许可协议,康方生物将获得 7000 万美元的首付款和里程碑款,以及依沃西在新增许可市场的销售提成(提成比例与 2022 年 12 月 5 日双方签订的合作协议的比例一致)。康方生物将继续为包括新增许可市场在内的所有许可市场供应依沃西单抗注射液,并获得供货收入。
同时,在补充许可协议中,双方进一步强化了包括临床试验数据、上市申报文件等成果的跨地区共享合作条款,以加速依沃西在全球各地区的监管注册及商业化。
Summit 将新增获得依沃西在中美、南美、中东和非洲等相关市场的开发及商业化独家权益。同时,Summit 将继续负责包括新增许可市场在内的所有许可地区的临床开发、产品注册及商业化,及其所有相关费用。
康方生物创始人、董事长夏瑜博士表示,此次补充许可协议的达成,体现了康方生物及合作伙伴 Summit 对依沃西突破性临床价值的强烈信心。
目前,基于 HARMONi-A 或 AK112-301 研究结果,国家药品监督管理局(NMPA)批准了依沃西上市,用于联合化疗治疗经表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)治疗进展的 EGFR 突变的局部晚期或转移性非鳞非小细胞肺癌(nsq-NSCLC)。
另外,依沃西单药对比帕博利珠单抗一线治疗 PD-L1 表达阳性(PD-L1 TPS≥1%)的局部晚期或转移性非小细胞肺癌(NSCLC)的注册性 III 期临床研究(HARMONi-2 或 AK112-303)期中分析达到主要研究终点 PFS,取得了决定性胜出阳性结果。
此两项重磅里程碑成果,强有力证明了依沃西在全球范围内巨大的临床价值和商业价值潜力,也将有力支持 Summit 主导开展的 2 项国际多中心 III 期临床研究(HARMONi 研究和 HARMONi-3 研究)的提速并取得临床成功。
3、GSK 收购 Elsie 公司,强化搭建寡核苷酸药物管线
6 月 6 日,GSK 宣布以最高 5000 万美元(约 3900 万英镑)收购 Elsie Biotechnologies。此次收购使得 GSK 能够整合 Elsie 的寡核苷酸发现、合成和递送技术,以增强 GSK 的平台研发能力。
据 Insight 数据库显示,两家公司此前就已有两项合作。GSK 此次表示,在 2023 年 7 月与 Elsie 的成功研究合作,使其在合作中探索并验证了这项技术。这可能是本次达成进一步合作的潜在原因之一。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..