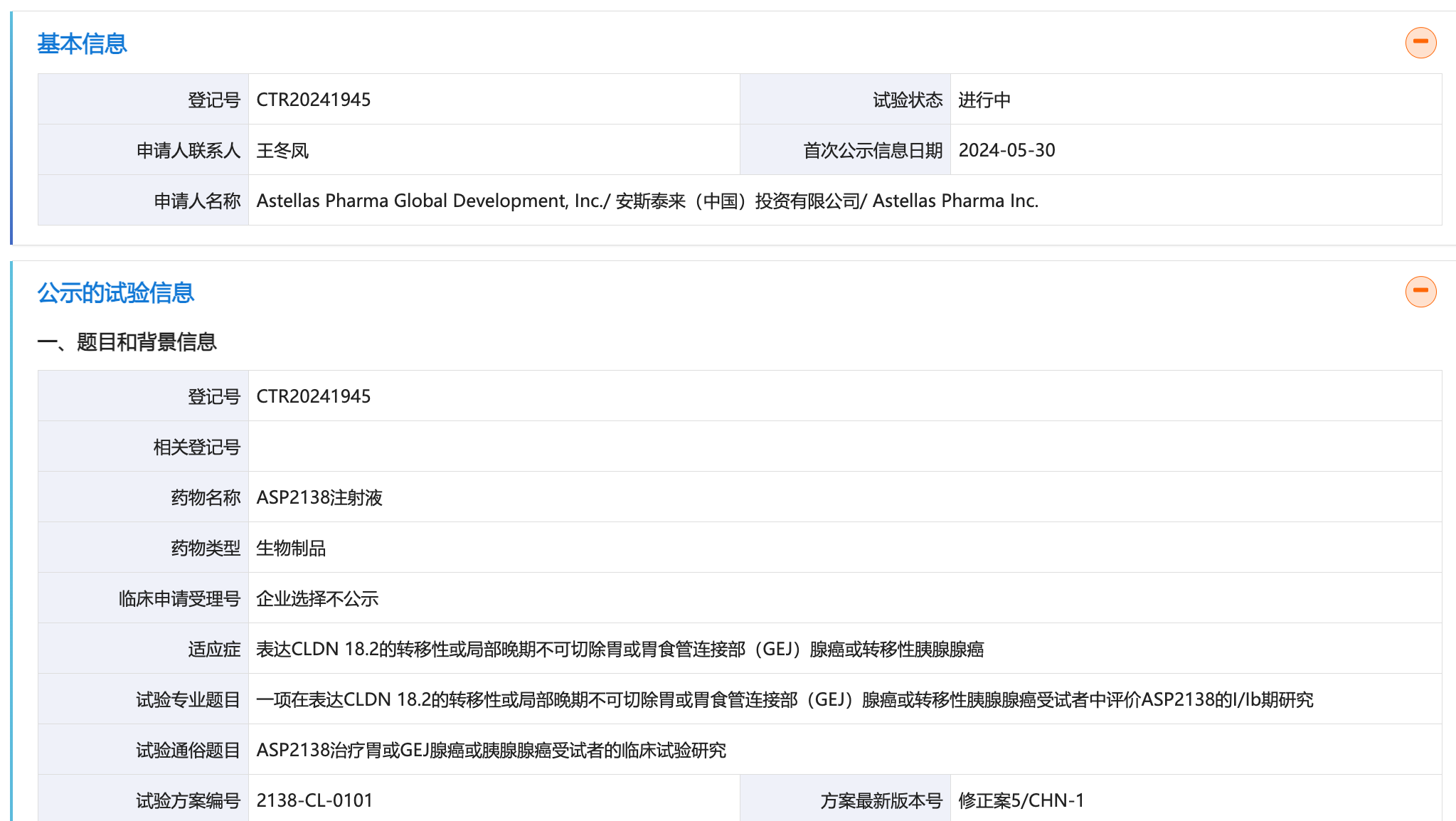
5 月 30 日,据 CDE 临床试验登记与信息公示平台显示,安斯泰来 CD3/CLDN18.2 双抗 ASP2138 国内启动 I/Ib 期研究,旨在评价在表达 CLDN 18.2 的转移性或局部晚期不可切除胃或胃食管连接部(GEJ)腺癌或转移性胰腺腺癌患者中的疗效与安全性 (登记号:CTR20241945)。
来自:CDE 官网
不过,该研究于 2022 年 5 月已在 ClinicalTrials.gov 上登记启动(登记号:NCT05365581),计划全球入组 275 人,并于 2022 年 6 月完成了首例受试者的入组工作。本次启动的是国内部分。
ASP2138 是一款双特异性抗体,可与 CD3 和 CLDN18.2 结合。据 Insight 数据库显示,安斯泰来还布局了一款 CLDN6/CLDN-18.2/CD3 双特异性三价抗体,目前暂未进入临床。
提及安斯泰来靶向 CLDN18.2 产品管线,不得不提及 CLDN18.2 单抗 zolbetuximab(佐妥昔单抗),今年 3 月在日本获批上市,治疗 CLDN18.2 阳性的不可切除晚期或复发性胃癌,成为全球首款且目前唯一一款获批的 CLDN18.2 靶向疗法。
不过,1 月份安斯泰来宣布收到了 FDA 发出的完整回复函,由于第三方生产工厂存在未解决缺陷,不能在 PDUFA 日期前批准 zolbetuximab上市,在美国的上市进度延缓。在国内,已在去年申报上市,当前正在审批中(受理号:JXSS2300066)。
胃癌是中国的高发癌种,据 WHO 2020 年度数据,发病率和死亡率均在中国居于第 3 位,在全球占比超过 40%。因此,CLDN18.2 靶点基于其治疗潜力和患者群体之广,目前全球研发也异常火热,布局企业除安斯泰来外,还涉及阿斯利康等。不过,在这一赛道,中国企业身影频现。据 Insight 数据库显示,共 79 个临床阶段项目,其中 68 个有中国企业的身影。
国内企业的深入布局可以说是显而易见的。信达、科济、创胜集团都布局了不少于 3 款不同类型 CLDN18.2 项目,其中信达全面囊括 ADC、CAR-T、双抗、单抗这四大分类。
从全球研发进展来看,除安斯泰来 zolbetuximab 获批上市之外,另有 8 款产品处于 III 期临床阶段(这其中有 4 款为 ADC),其他 CLDN18.2 项目目前多处于较早期临床阶段。
从成分类别来看,进入临床阶段的项目中,涉及双抗、单抗、CAR-T、ADC 等,其中 CAR-T 居于第一,有 22 款在研。
而聚焦到 CD3/CLDN18.2 双特异性抗体来看,据 Insight 数据库显示,当前全球共有 17 款产品在研,其中进入临床的仅 5 款,在第一梯队里中国企业仍是身影频现。
进展略快的为信达 IBI389,去年 11 月已登记启动一项单臂、II 期临床试验(登记号:ChiCTR2300077565)。针对胰腺癌以及胃癌患者的 I 期临床试验数据将在 2024ASCO 大会上公布,近期公布了摘要数据,先来一睹为快:
针对胰腺癌患者,IBI389 剂量为 600ug/kg,在 CLDN18.2 表达≥10%(免疫组织化学 2+/3+)的患者中观察到初步疗效。在 23 例可评估的患者中,其中 PR 7 人,SD 9 人。ORR 为 30.4%,DCR 为 69.6%。中位 DoR、PFS 尚未达到。针对胃癌,在 CLDN18.2 表达≥10% 的患者中观察到 IBI389 的初步疗效。在先前接受过≥2 线治疗的 G/GEJ C 患者中,接受 10ug/kg 至 600ug/kg 剂量的 IBI389 治疗 (n=26),8 名患者出现 PR,11 名患者 SD。ORR 为 30.8%,DCR 为 73.1%。
另 4 款均处于 I 期或 I/II 期阶段,除安斯泰来(ASP2138)外,还涉及齐鲁(QLS31905)、阿斯利康/和铂医药(AZD5863 / HBM7022)以及安进/百济神州(AMG910)。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..