疫苗类生物制品的清洁验证是保证其质量和安全的重要环节,其中总有机碳(TOC)检测是评价清洁效果的常用指标。旨在探讨疫苗类生物制品清洁验证中 TOC 检测限度的评估方法及应用。以常见疫苗生产用主要培养基配制为例,检测配制过程中最难清洗物的 TOC,每种检测 3 批,要求相对标准偏差(RSD)≤10%。按照清洗方式将需清洗设备、容器具进行分类,根据公式计算各设备、容器具在最差条件下的 TOC 限度,选取最低值作为该种清洗方式的 TOC 检测限度。结果显示,离线清洗(COP)方法 TOC 限度标准为 0. 250 mg / L,COP 手工清洗方法 TOC 限度标准为 0. 100 mg / L,在线清洗(CIP)方法 TOC 限度标准为 0. 080 mg / L。提出的 TOC 检测限度的评估方法可广泛应用于疫苗生产行业的清洁验证,为保障疫苗质量提供科学依据。
疫苗类生物制品是指能够诱导宿主产生特异性免疫应答,从而预防或治疗某些传染病的制剂,包括灭活疫苗、减毒活疫苗、重组疫苗、亚单位疫苗等。疫苗类生物制品的质量和安全直接关系到人类健康和公共卫生,因此需要严格遵循 《 药品生产质量管理规范》(GMP)的要求,进行有效的质量控制和质量保证[1-2]。清洁验证是 GMP 的重要组成部分,是指对生产过程中可能造成交叉污染的设备、容器、管道等进行清洗,并验证其清洁效果是否达到预定标准的过程。清洁验证[3]的目的是确保每批生物制品的纯度和一致性,防止微生物、内毒素、残留物等对产品质量和安全性的影响。本文旨在探讨疫苗类生物制品清洁验证中 TOC检测限度的评估方法及应用。
Part.01
材料与方法
1.1 实验材料
离线清洗(COP)是指需要拆卸设备部件并将其带到专用的清洗区域进行清洗的过程。手工清洗是一种COP的方式,通常使用刷子、海绵或布等工具,配合清洗剂进行清洗。手工清洗的优点是灵活性高,可以针对不同的设备和污染程度进行调整。手工清洗的缺点是效率低、重复性差、人为误差大、清洗质量难以保证。在线清洗(CIP)是指不需要拆卸设备,而是在密闭的条件下,通过自动化的系统,使用清洗剂和水进行循环清洗的过程。CIP 的优点是节省时间和人力、清洗参数可控、清洗效果可验证、清洗质量高。CIP 的缺点是需要专门的清洗设备和管道,清洗剂的消耗和排放也较大。TOC(总有机碳)检测是一种用于测量水中有机物含量的方法,它可以反映水的纯度和清洁程度。在清洁验证中,TOC检测的意义是可以作为一种快速、灵敏、无损的方法,用于评估清洗后的设备表面是否有残留的有机物,从而判断清洗效果是否达到预期的标准。本文所用的清洗剂为注射用剂,所用的仪器为TOC 分析仪(Sievers 900,美国)、pH 计(Mettler Toledo,瑞士)、天平(Sartorius,德国)等。
1.2 实验方法
1.2.1 TOC 检测方法
本文采用湿法氧化法进行 TOC 检测,即将样品在高温高压的条件下与高纯氧反应,将有机碳氧化为二氧化碳,然后用红外线检测器测定二氧化碳的浓度,从而计 算 出 TOC 的 含 量。TOC的检测限度一般为0.5 mg/L,准确度为±5%,重复性为±3%。根据疫苗类生物制品清洁验证中TOC检测限度的评估方法及应用,TOC的限度标准应根据不同的清洁方式、设备、容器等进行分类计算,选取最低值作为该种清洁方式的TOC检测限度。一般情况下,TOC的限度标准在0.1~1.0 mg/L 之间。如果待测水样的TOC含量低于限度标准,说明清洁验证的效果良好,反之则说明清洁验证的效果不佳,需要重新清洗或者优化清洁工艺。
1.2.2 取样方法
本文根据不同的清洗方式,选择不同的取样方法。对于离线清洗(COP)方法,由于设备、容器表面不易冲洗,因此采用直接取样法。对于 COP 手工清洗方法和在线清洗(CIP) 方法,由于设备、容器表面可以冲洗,因此采用间接取样法。
1.2.3 取样回收率
取样回收率是指在取样过程中,设备、容器表面的TOC 转移到水中的比例,是评价取样方法有效性的重要指标。取样回收率的计算公式为:回收率 = 取样前的 TOC 含量/ 取样后的 TOC 含量×100%。
Part.02
实验设计
本文以常见疫苗生产用主要培养基配制为例,探讨疫苗类生物制品清洁验证中 TOC 检测限度的评估方法及应用。为了评估疫苗类生物制品清洁验证中TOC 检测限度,本文将需清洗的设备、容器按照清洗方式分为 3 组,分别为离线清洗(COP)、COP 手工清洗和在线清洗(CIP)。COP 方法适用于可拆卸的设备、容器具,如血浆瓶、硅胶管等;COP 手工清洗方法适用于不可拆卸但可用手工擦拭的设备、容器具,如立瓶、滤器、不锈钢分装罩等;CIP 方法适用于不可拆卸且不可用手工擦拭的设备、容器具,如培养基配制罐的内壁、管道、阀门等。本文选取了各组中最具代表性的设备、容器进行实验。
Part.03
结 果
3. 1 TOC 检测结果
表 1 显示了各组设备、容器的 TOC 检测结果,包括平均值、标准差、RSD 等。从表中可以看出,各组设备、容器的 TOC 质量浓度均低于 1 mg / L,且 RSD 均小于 10%,说明 TOC 检测方法的精密度和准确度较高,清洁效果较好。
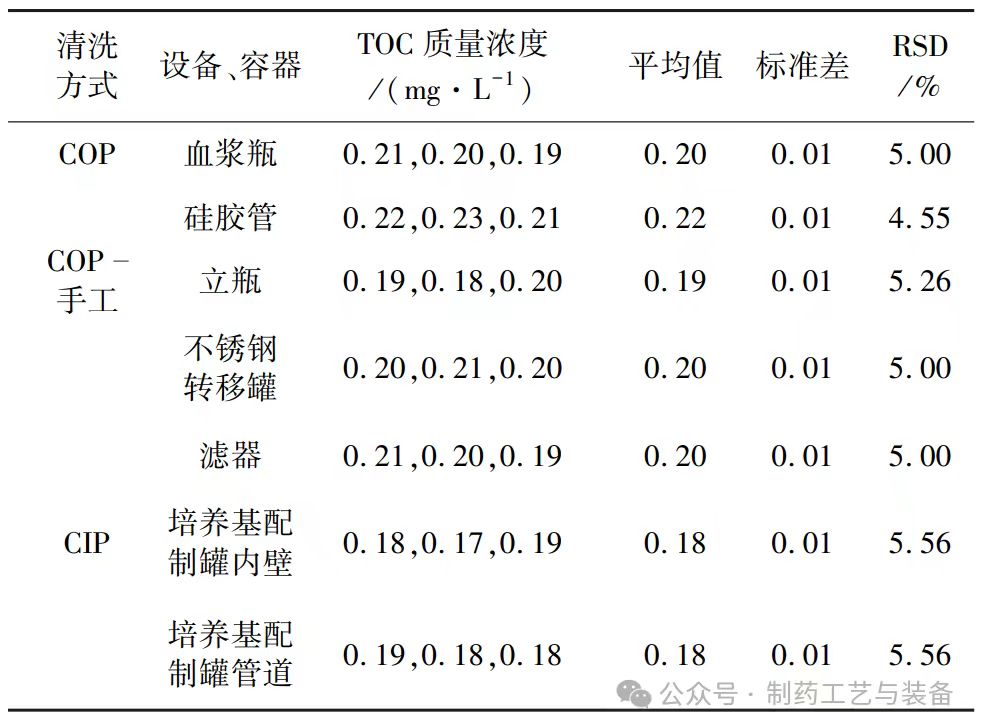
表1 TOC 检测结果
3. 2 TOC 检测限度的评估结果
表 2 显示了各组设备、容器的 TOC 检测限度,按照最低值的原则确定该组的 TOC 检测限度标准。从表中可以看出,离线清洗(COP)方法 TOC 限度标准为0. 250 mg / L,COP 手工清洗方法 TOC 限度标准为0. 100 mg / L,在线清洗(CIP) 方法 TOC 限度标准为0. 080 mg / L。这些 限 度 标 准 均 低 于 国 际 上 通 用 的0. 5 mg / L 的限值,说明本文提出的 TOC 检测限度的评估方法具有较高的灵敏度和严格性。
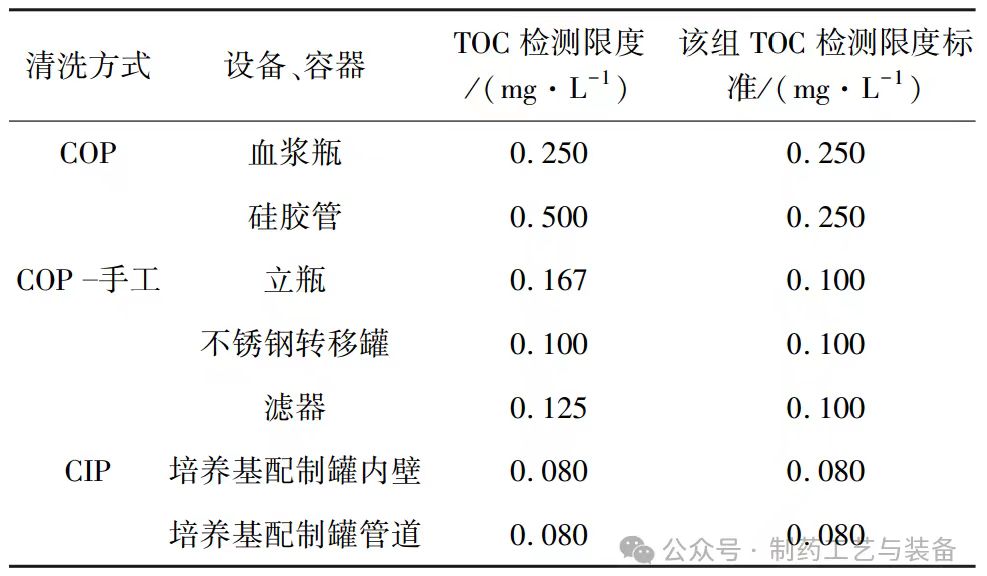
表2 TOC 检测限度的评估结果
Part.04
讨 论
以常见疫苗生产的主要培养基配制为例,探讨了疫苗类生物制品清洁验证中 TOC 检测限度的评估方法及应用[4]。提出的评估方法是根据各设备、容器具在最差条件下的 TOC 限度,选取最低值作为该种清洗方式的 TOC 检测限度标准,这样可以保证清洁验证的严格性和可靠性,避免因为设备、容器具的不同而导致的清洁效果差异。本研究结果显示,不同清洗方式的TOC 检测限度标准有所差异,其中在线清洗(CIP) 方法的 TOC 检测限度标准最低,为 0. 080 mg / L,这说明CIP 方法的清洁效果最好,也最符合疫苗类生物制品的高质量要求。
本研究方法和结果与国内外相关研究相比有一定的创新性和优势。采用了 TOC 检测作为清洁验证的主要指标,而不是传统的微生物检测或者化学检测,这样可以更全面、更敏感、更快速地评价清洁效果,也更适合疫苗类生物制品的特点。本文的研究也存在局限性和不足。本文的研究对象只是常见疫苗的一种生产工艺,不能代表所有的疫苗类生物制品,也不能涵盖所有的清洁验证场景,因此本文的研究结果需要在更多的疫苗类生物制品和清洁验证过程中进行验证和优化。
本研究为疫苗类生物制品的清洁验证提供了一种新的评估方法和应用实例,为保障疫苗质量提供了科学依据,对提高我国疫苗类生物制品清洁验证的水平和质量具有一定的参考价值和意义。
参考文献
[1] 王元,李武超,江映珠,等. 我国疫苗生产企业质量风险管理实施情况问卷调研及结果分析[J]. 中国药事,2022,36(10):1122 1133.
[2] 李春雪. 兽药生产中质量风险管理在清洁验证中的应用[J]. 饲料博览,2021(3):38 39,44.
[3] 袁哲,雷智丰,赵文彧,等. 南水北调汉江水质变化后某水厂臭氧 活性炭深度处理工艺优化研究[J]. 给水排水,2023,49(4):16 24.
[4] 罗康宁,廖安邦,肖孟阳,等. 滩涂湿地蟹类活动对表层土壤的扰动效应[J]. 生态科学,2021,40(6):83 88.
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..