5月7日,中国国家药监局药品审评中心(CDE)官网公示,腾盛博药申报的两款产品拟纳入突破性治疗品种,针对适应症均为:治疗慢性乙型肝炎病毒(HBV)感染和HBV/丁型肝炎病毒(HDV)感染。
公开资料显示,BRII-835和BRII-877分别为皮下注射的siRNA药物和单抗药物,二者有相互叠加作用,可显著降低乙型肝炎表面抗原(HBsAg),无显著的临床安全信号。作为腾盛博药开发HBV功能性治愈独特方法的一部分,腾盛博药与其合作伙伴正在针对两款产品开展多项联合用药研究。
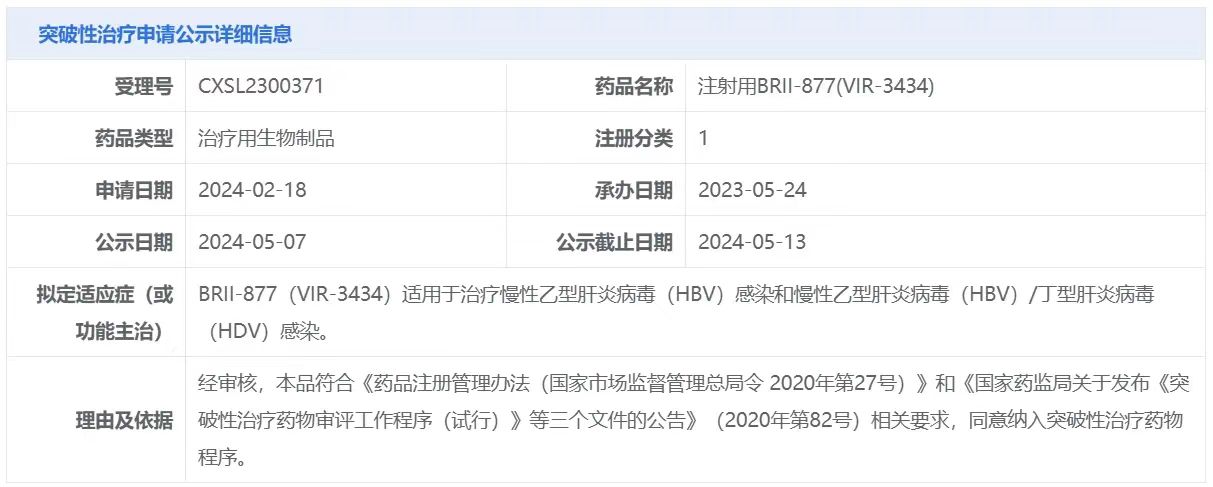
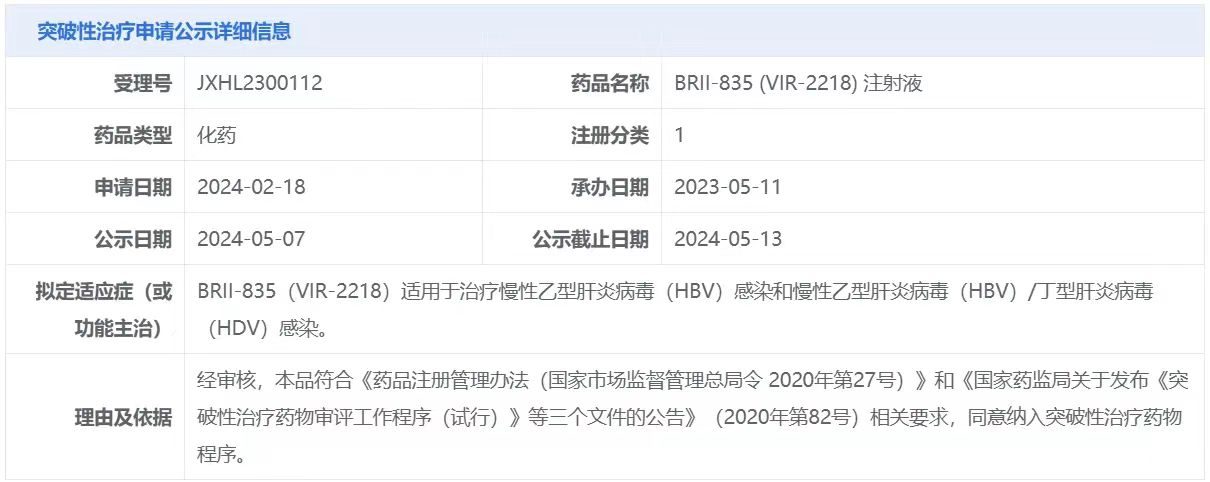
截图来源:CDE官网
BRII-835是一种经皮下注射给药的靶向HBV的siRNA研究性药物,具有对HBV直接抗病毒活性和诱导有效免疫应答的潜力。该siRNA产品采用增强型稳定化学+(ESC+)技术,可增强稳定性并最大程度地降低脱靶效应,从而可提升治疗效力。腾盛博药于2020年从Vir Biotechnology获得了该产品在大中华地区开发和商业化的权利 。
BRII-877是一种皮下注射的研究性HBV中和单克隆抗体,旨在阻断所有10种基因型的HBV进入肝细胞,并降低血液中病毒颗粒和亚病毒颗粒的水平。该产品结合了Xencor的Xtend和其他Fc技术,通过这些改造,有希望在感染患者中作为针对HBV的T细胞疫苗,并具有延长的半衰期。腾盛博药于2022年从Vir公司获得了BRII-877在大中华区的独家开发和商业化权益。
根据腾盛博药近期发布的2023年年度报告介绍,研究人员在2023年11月的美国肝病研究协会年会(AASLD)上展示了针对慢性乙肝病毒感染的2期MARCH研究B部分的新数据。数据显示,在将BRII-877(tobevibart)加入联合或不联合PEG-IFNa的BRII-835(elebsiran)方案中治疗24周后,应答率提高约三倍。BRII-877+BRII-835+PEG-IFNa的应答率为15.0%,BRII-877+BRII-835的应答率为14.3%。治疗48周的队列数据将于2024年第四季度公布。
更早些公布的MARCH试验A部分评估了BRII-835和BRII-877在慢乙肝受试者中联合用药的短期疗程效果。数据表明,患者HBsAg水平下降了2.7~3.1 log10 IU/mL,90%的受试者在治疗结束时HBsAg水平小于10 IU/mL。
研究人员还分享了SOLSTICE研究中一小部分慢性丁型肝炎参与者的初步数据。经过12周的BRII-877和BRII-835联合治疗后,6名参与者中有5人无法检测到HDV RNA,6名参与者中有6人的HDV RNA低于定量下限。其他数据将于2024年第二季度公布,完整的24周治疗数据将于2024年第四季度公布。
参考资料:
[1]中国国家药监局药品审评中心(CDE)官网. Retrieved May 7, 2024, from https://www.cde.org.cn/main/xxgk/listpage/9f9c74c73e0f8f56a8bfbc646055026d
[2]腾盛博药在2023年美国肝病研究协会年会(AASLD)上发布最新数据,强调在实现HBV功能性治愈方面的进展. Retrieved Nov 14, 2023, from https://mp.weixin.qq.com/s/aILGNJqPKibAKEFqD9UV4Q
[3]腾盛博药发布2023年度全年财务业绩及公司最新进展. Retrieved Mar 22, 2024, from https://mp.weixin.qq.com/s/b8WkAqpQ_NW09rgJgjKuyQ
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..