1 月 25 日,据 CDE 官网显示,赛诺菲/再生元度普利尤单抗注射液新适应症国内报上市(受理号:JXSS2400002),适应症暂未披露。
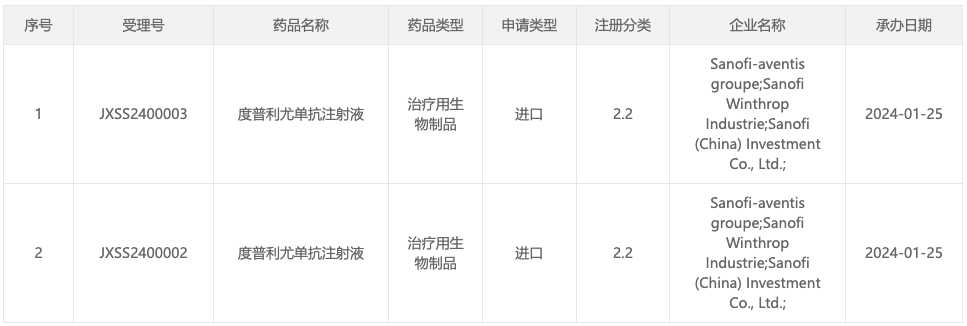
来自:CDE 官网
度普利尤单抗此前已在国内获批 6 项适应症,首次上市批准时间为 2020 年 6 月,用于治疗成人中重度特应性皮炎;随后陆续拓展人群至 12 岁及以上患者,以及 6~12 岁患者,去年 5 月又将获批年龄拓展至 6 个月至 5 岁。此外,在去年 9 月、11 月又先后获批结节性痒疹以及哮喘适应症。
度普利尤单抗(Dupilumab/Dupixent)是赛诺菲与再生元合作开发的一款人源性单克隆抗体,靶向 IL-4Rα。通过结合 IL-4Rα,度普利尤单抗可同时阻断 IL-4 和 IL-13 信号通路,IL-4 和 IL-13 被认为是特应性皮炎持续性炎症的主要驱动因子。
2017 年 3 月,度普利尤单抗获 FDA 批准成为首个用于治疗成人中重度特应性皮炎的靶向生物药,商品名为 Dupixent®。此后,又先后获批了哮喘、鼻息肉、结节性痒疹、婴幼儿特应性皮炎以及嗜酸性食管炎适应症,且还在拓展其他适应症,包括慢性阻塞性肺病(COPD)。
去年 3 月,针对 COPD 的首项 III 期临床 BOREAS 研究成功,意味着度普利尤单抗成为首个证明对 COPD 患者有显著临床获益的生物制剂。
BOREAS 研究旨在评估度普利尤单抗在伴发气道疾病 2 型炎症的中重度 COPD 患者中的疗效以及安全性。主要终点为 52 周内中重度 COPD 的急性发作率。
该研究共纳入 939 例 40-80 岁患者。结果显示,52 周内中重度 COPD 的急性发作减少了 30%(p = 0.0005);第 12 周时度普利尤单抗治疗组患者 FEV1 较基线提高 160 mL,而安慰剂组为 77 mL (p<0.0001)。此外,BOREAS 研究治疗达到了所有次要终点。
去年 11 月,针对中重度 COPD 开展的第 2 项 III 期临床 NOTUS 研究达到主要终点。
NOTUS 研究共纳入 935 例患者。结果显示,达到主要终点,接受度普利尤单抗治疗 52 周,中重度 COPD 的急性发作减少 34%(p=0.0002)。此外,第 12 周时,度普利尤单抗治疗组患者肺功能(通过支气管扩张剂前 FEV1 评估肺功能)较基线提高 139 mL,安慰剂组为 57 mL(p=0.0001),益处持续到第 52 周,普利尤单抗组为 115 mL,安慰剂组则为 54 mL(p=0.0182)。
在安全性方面,与度普利尤单抗在已批准适应症的安全性数据基本一致。Dupixent 不良事件(AE)发生率为 67%,安慰剂组为 66%,常见 AE 包括鼻咽炎、头痛等。
彼时,赛诺菲表示将在去年年底递交该适应症的上市申请,度普利尤单抗有望成为首款 COPD 生物制剂创新药。
度普利尤单抗上市首年即实现销售额 2.51 亿美元,到 2022 年已猛涨至约 87.31 亿美元年销售额,在全球药品销售额 TOP 榜上稳坐前列;目前仍然维持着高涨幅,2023 Q3 全球销售额同比增长 32.8%,赛诺菲预计 2023 年全年销售额将超百亿美元(110 亿欧元)。而随着度普利尤单抗即将迈进 COPD 这个广阔市场,很有可能将销售额天花板提高到 200 亿美元以上,进入下一代「药王」的角逐赛。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..