1月17日,罗氏在ASCO胃肠道肿瘤研讨会上提交了其TIGIT单抗Tiragolumab联合疗法一线治疗食管鳞状细胞癌(ESCC)的III期SKYSCRAPER-08研究数据。
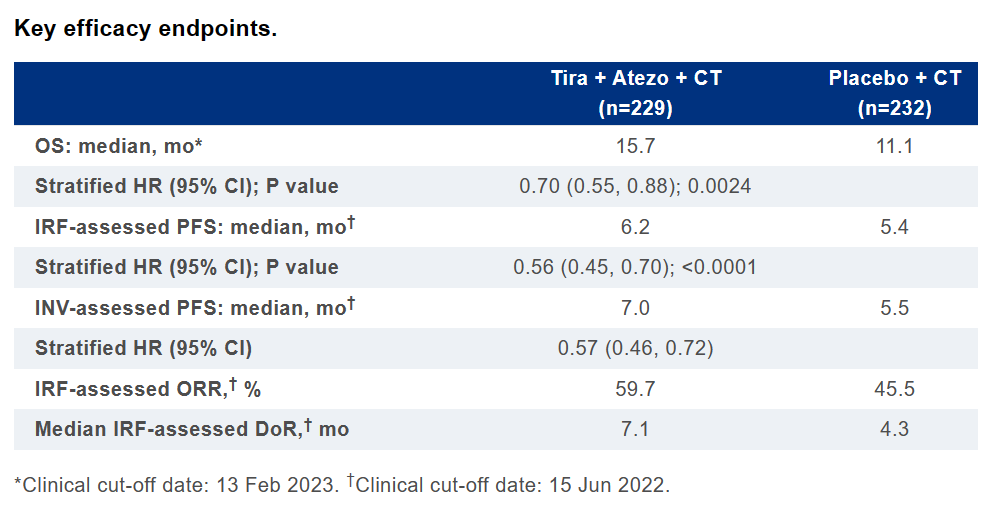
该研究是一项随机、双盲、安慰剂对照临床试验(n=461),评估了Tiragolumab+阿替利珠单抗+化疗对比安慰剂+化疗一线治疗不可切除的局部晚期、复发性或转移性ESCC患者的疗效和安全性。研究的主要终点为无进展生存期(PFS)和总生存期(OS)。
结果显示,该研究达到了双重主要终点。截至2022年6月15日,Tiragolumab组经独立中央审查机构(IRF)评估的中位PFS为6.2个月,安慰剂组则为5.4个月(HR =0.56;95%CI:0.45, 0.70;p<0.0001 )。Tiragolumab组经研究者评估的PFS为7.0个月,安慰剂组为5.5个月(HR=0.57;95%CI:0.46, 0.72)。
截至2023年2月13日,Tiragolumab组经IRF评估的中位OS为15.7个月,安慰剂组则为11.1个月(HR=0.70;95%CI:0.55, 0.88;p= 0.0024)。
安全性方面,两组有98.2%的患者发生治疗相关不良事件(TRAE)。Tiragolumab组和安慰剂组分别有59.6%和56.4%的患者发生3/4级TRAE ,分别有2.6%和0.9%的患者发生5级TRAE。
此前,罗氏对Tiragolumab的疗效已进行了多次探索,针对非小细胞肺癌和小细胞肺癌均开展了一项III期临床试验,但这两项研究均以失败告终(见:罗氏PD-L1+TIGIT组合一线治疗PD-L1高表达非小细胞肺癌III期失败)。此次,该药物首次在III期研究中获得积极结果,也算是进一步提振了罗氏以及行业对TIGIT靶点的信心。
不过,罗氏在SKYSCRAPER-08研究中选择的对照组为安慰剂+化疗,并不足以充分证明Tiragolumab在ESCC患者中的疗效,因而其也为进一步证明该药物的疗效准备了SKYSCRAPER-07研究(对照组为阿替利珠单抗+放化疗)。这项研究预计将在今年年底完成,届时也可知晓其疗效究竟如何。
除了罗氏以外,还有多家药企在推进TIGIT抗体药物的临床开发。目前,全球共4款TIGIT靶向药物处于III期研究阶段,分别为Tiragolumab(罗氏)、Vibostolimab(MK-7684A中的TIGIT部分,默沙东)、Domvanalimab(吉利德/Arcus Biosciences/Taiho Pharmaceutical)和欧司珀利单抗(百济神州)。
默沙东正在开展5项MK-7684A的全球性III期临床试验,挑战的对象包括度伐利尤单抗、帕博利珠单抗和阿替利珠单抗;吉利德/Arcus Biosciences也开展了4项domvanalimab的全球性III期临床试验,挑战的对象包括度伐利尤单抗、帕博利珠单抗和纳武利尤单抗;百济神州共开展了2项欧司珀利单抗的全球性III期临床试验,挑战的对象亦包括度伐利尤单抗和帕博利珠单抗。
在这之中,百济神州开展的替雷利珠单抗+欧司珀利单抗对比帕博利珠单抗+安慰剂治疗非小细胞肺癌的III期研究将率先在2025年5月完成。国内药企能否在TIGIT靶点上后来居上,值得期待。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..