近期,安进/百济在 CDE 临床试验登记与信息公示平台上首次登记启动了 CD3/STEAP1 双抗 AMG 509 的 I 期临床试验,针对转移性去势抵抗性前列腺癌(mCRPC)。
AMG 509 为全球首款也是当前唯一一款进入临床阶段的 CD3/STEAP1 双抗。

来自:CDE 官网
AMG 509 是一款 CD3/STEAP1 双抗,可与人、灵长类动物的 STEAP1 抗原和 T 细胞表面的 CD3 受体结合。
前列腺跨膜上皮抗原 1(STEAP1)是一种由雄激素诱导并在前列腺癌中高表达的细胞表面抗原。STEAP1 在尤因肉瘤(EWS)中也高度表达,且会形成 EWS / FLI1 的融合。EWS / FLI1 融合是该恶性肿瘤的主要致癌驱动因素。
在结构设计上,安进利用了 Xencor 公司的 Xmab 2+1 非对称技术,且延长了这一蛋白的半衰期。

AMG 509 刚于今年 6 月在国内首次获批临床,并于今日首次启动临床。在境外,据 Insight 数据库显示,安进当前正在开展一项 AMG 509 治疗去势抵抗性前列腺癌的 I 期临床试验(登记号:NCT04221542)。该试验于 2020 年 3 月启动,预计于 2026 年 6 月完成试验的主要指标。2023 ESMO 大会上公布的中期分析数据已显示出积极结果,详见下图:
NCT04221542 中期结果

来自:Insight 数据库网页版(下同)
百济与安进在 2019 年 11 月达成了全球肿瘤战略合作关系,与安进共同开发包括 Tarlatamab 在内的 20 款抗肿瘤管线药物。据 Insight 数据库显示,在百济与安进合作的双抗项目中,百济已将 7 款双抗在国内推进至临床开发阶段。
百济/安进共同研发 7 款双抗国内进入临床
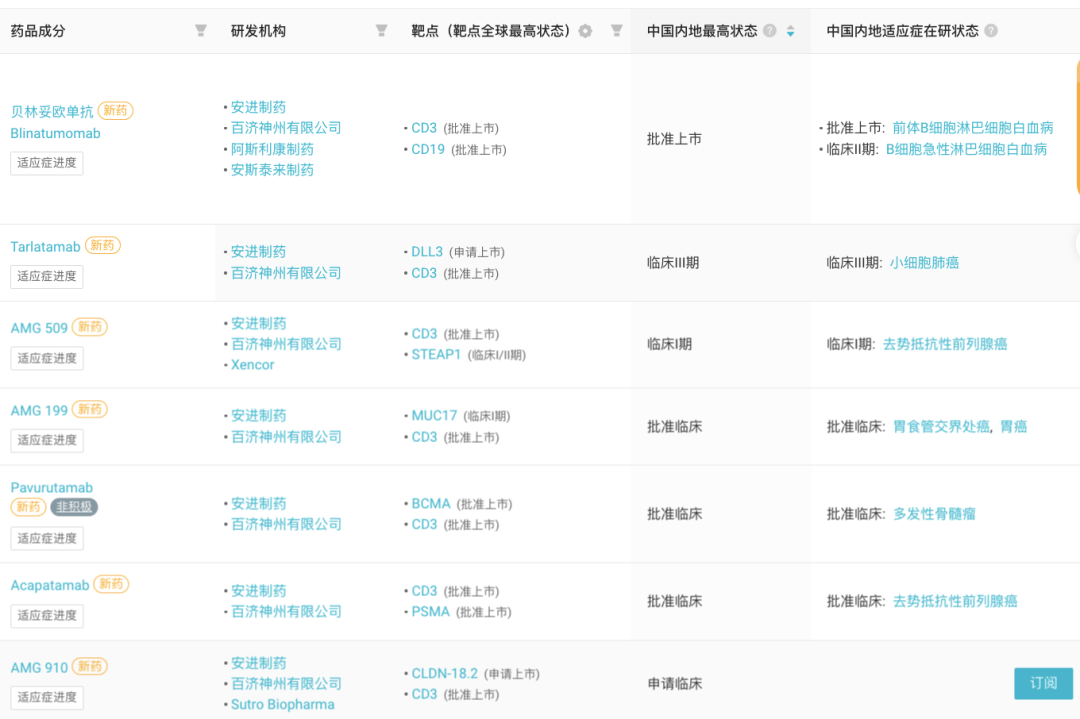
开发进展最快的是贝林妥欧单抗以及 Tarlatamab。
贝林妥欧单抗(Blinatumomab,倍利妥®)是一款双特异性 CD19 导向的 CD3 T 细胞衔接分子(BiTE®),一端可与 B 系细胞表面表达的 CD19 结合,而另一端可与 T 细胞表面表达的 CD3 结合。
贝林妥欧单抗在国内已于 2020 年 12 月获批上市,用于治疗成人复发或难治性(R/R)前体 B 细胞急性淋巴细胞白血病(ALL)。此后,在去年 5 月,将适应症人群拓展至儿童患者。
DLL3/CD3 双抗 Tarlatamab/AMG757 则刚于上周传来新动态,Tarlatamab 的 BLA 申请获 FDA 受理并获优先审评资格,针对晚期 NSCLC。PDUFA 决定日期在 2024 年 6 月 12 日。有望成为全球首款 DLL3/CD3 双抗。详见 Insight 往期报道>>>全球首款!安进 DLL3/CD3 双抗上市申请获 FDA 优先审评
在国内,Tarlatamab 已进入 III 临床阶段,7 月启动了 III 期 DeLLphi-304 研究的国内部分(登记号:CTR20232049),旨在评价 Tarlatamab 对比标准疗法在接受含铂一线化疗后的复发性小细胞肺癌受试者中的疗效和安全性。计划全球受试者为 700 人,国内 107 人,9 月已完成国内首例受试者的入组工作。
Tarlatamab 用于复发或难治性 SCLC 的 I 期临床试验结果显示:在既往接受过中位 2 线治疗,其中 49.5% 患者接受过抗 PD-1/L1 抑制剂治疗的患者中,ORR 为 23.4%,mDoR 为 12.3 个月,DCR 为51.4%,mPFS 和 mOS 分别为 3.7个月和 13.2 个月。在安全性方面,任意级别 TRAE 发生率为 90.7%,≥3级 TRAE 发生率为30.8%;未达到最大耐受量。
此外,在 2023 ASCO 会上公布的数据则表明, Tarlatamab 在 ES-SCLC 患者中,无论是否存在 BM,都具有令人鼓舞的疗效和安全性。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..