12 月 19 日,据 CDE 官网显示,诺华琥珀酸瑞波西利片新适应症国内申报上市(受理号:JXHS2300126)。推测适应症可能为辅助治疗 HR+/HER2-早期乳腺癌患者。
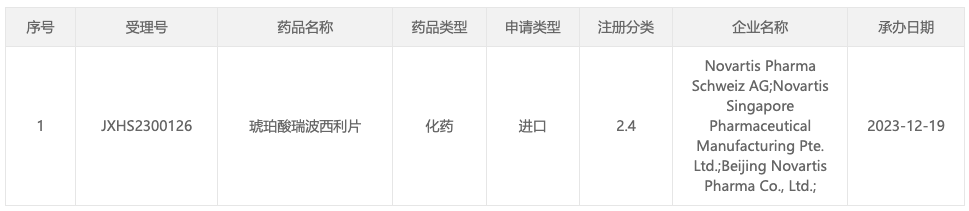
来自:CDE 官网
Ribociclib(瑞波西利/利柏西利/Kisqali)是全球第 2 款获批上市的 CDK4/6 抑制剂。此前已在美国获批多项适应症,据诺华财报显示,Ribociclib 2022 年全年销售额已达 12.31 亿美元。
瑞波西利在美国获批适应症

来自:Insight 数据库网页版
在国内,Ribociclib 在 2021 年 10 月首次申报上市,并于今年 1 月首次获批上市,作为 HR+/HER2- 局部晚期或转移性乳腺癌绝经前或围绝经期女性患者的初始内分泌治疗,使用内分泌疗法治疗时应联用黄体生成素释放激素(LHRH)激动剂。此后,又在今年 5 月获批一线治疗 HR+/HER2- 绝经后晚期乳腺癌。
诺华此前披露了 Ribociclib 联合非甾体芳香化酶抑制剂治疗 HR+/HER2- 早期乳腺癌患者辅助治疗的 III 期 NATALEE 研究结果。
2023 ASCO 会议上公布的数据显示,Ribociclib + 非甾体芳香化酶抑制剂(NSAI)治疗比单用 NSAI 在无侵袭性疾病生存率(iDFS)方面有显著优势(HR=0.748;95% CI,0.618-0.906;P =0.0014)。
2023 SABCS 会上披露了最新 iDFS 数据。
截止 2023 年 07 月 21 日,瑞波西利(RIB)+非甾体芳香化酶抑制剂(NSAI)组的 2549 例患者中,2.8% 完成了 3 年 RIB 治疗,35.5% 提前停用 RIB 或 RIB+NSAI,20.7% 仍在使用 RIB。NSAI 组 68.5% 继续接受治疗。
结果显示,中位随访时间 33.3 个月,与单独 NSAI 治疗相比,RIB+NSAI 可显著降低 25.1% 的疾病复发风险(HR=0.749;95%CI:0.628-0.892;p=0.0006;RIB+NSAI 组、NSAI 组 3 年的 iDFS 率分别为 90.7% 和87.6%;且在所有次要疗效终点上的数据也是一致的,包括无远处转移生存期(DDFS)风险降低 25.1% 以及无复发生存期(RFS)风险降低 27.3%。安全性方面,未观察到新的安全信号。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..