诺华公司(Novartis)今天宣布,美国FDA批准Fabhalta(iptacopan)上市,作为治疗成人阵发性夜间血红蛋白尿症(PNH)的首个口服单药疗法。Fabhalta是一种补体B因子抑制剂,它在免疫系统的替代补体途径中起作用,全面控制血管内外的红细胞(RBC)破坏。临床试验显示,Fabhalta在大多数患者中有效提高血红蛋白水平,并且在3期临床试验APPLY-PNH中,几乎所有使用Fabhalta的患者都没有接受输血。这款药物被行业媒体Evaluate列为10款值得关注的潜在重磅疗法之一。
FDA的批准基于3期临床试验APPLY-PNH。该试验包括血红蛋白<10 g/dL且以前接受过抗C5疗法治疗但仍有残余贫血的患者。结果显示,Fabhalta在提高血红蛋白水平和避免输血方面优于继续使用抗C5疗法治疗的患者。批准还得到了3期临床试验APPOINT-PNH的支持,该研究针对未接受过补体抑制剂治疗的患者。APPLY-PNH和APPOINT-PNH试验24周的主要发现包括:
82.3%接受过抗C5疗法治疗的患者在无输血的情况下,接受Fabhalta治疗后血红蛋白水平持续增加≥2 g/dL,继续接受抗C5疗法治疗的患者这一数值为0%(P<0.0001)。未接受过补体抑制剂治疗的患者中,77.5%的患者接受Fabhalta治疗后达到了这一结果。
在无输血的情况下,67.7%接受过抗C5疗法治疗的患者血红蛋白水平持续≥12 g/dL,继续接受抗C5疗法治疗的患者这一数值为0%(P<0.0001)。
对于接受过抗C5疗法治疗的患者,接受Fabhalta治疗后避免输血率为95.2%,而抗C5疗法组患者这一数值为45.7%(P<0.0001)。
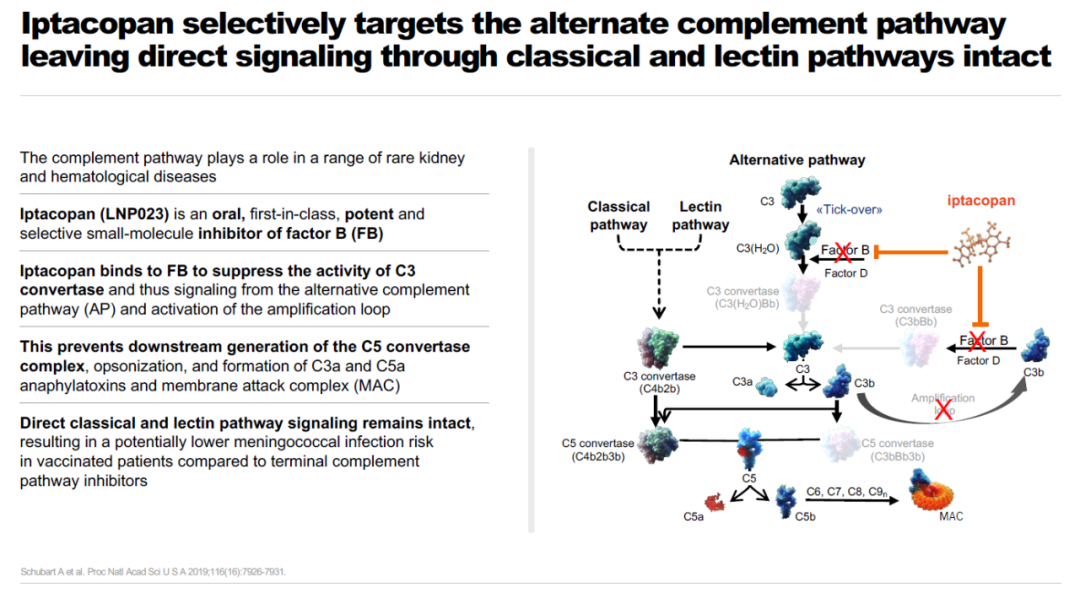
▲Iptacopan简介(图片来源:诺华公司官网)
在APPLY-PNH试验中,Fabhalta与抗C5疗法相比最常报告的不良反应(≥10%)包括:头痛(19%比3%),鼻咽炎(16%比17%),腹泻(15%比6%),腹痛(15%比3%),细菌感染(11%比11%),恶心(10%比3%)和病毒感染(10%比31%)。在APPOINT-PNH试验中,最常报告的不良反应(≥10%)包括头痛(28%),病毒感染(18%),鼻咽炎(15%)和皮疹(10%)。在APPLY-PNH中,接受Fabhalta治疗的PNH患者中有两名(3%)报告了严重的不良反应,包括肾盂肾炎、尿路感染和COVID-19。在APPOINT-PNH中,接受Fabhalta治疗的PNH患者中有两名(5%)报告了严重的不良反应,包括COVID-19和细菌性肺炎。
Fabhalta是诺华公司的重点研发项目之一,除了用于治疗PNH,它在治疗IgA肾病的3期临床试验中也已达到主要终点,预计于2024年递交加速批准的监管申请。
参考资料:
[1] Novartis receives FDA approval for Fabhalta® (iptacopan), offering superior hemoglobin improvement in the absence of transfusions as the first oral monotherapy for adults with PNH. Retrieved December 5, 2023, from https://www.globenewswire.com/news-release/2023/12/06/2791405/0/en/Novartis-receives-FDA-approval-for-Fabhalta-iptacopan-offering-superior-hemoglobin-improvement-in-the-absence-of-transfusions-as-the-first-oral-monotherapy-for-adults-with-PNH.html
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..