Atsena Therapeutics今天宣布,美国FDA授予其在研基因疗法ATSN-101再生医学先进疗法(RMAT)认定。此RMAT认定主要是基于该疗法临床1/2期试验6个月的积极疗效数据。

今年4月底所公布的数据表明,视网膜下给药ATSN-101具有良好的耐受性,没有出现与药物相关的严重不良事件。接受最高剂量治疗的患者在治疗6个月后在视网膜敏感性、BCVA等视觉功能方面有临床意义的改善,BCVA改善大于0.3 log MAR,而未接受过治疗眼睛的BCVA则出现下降。
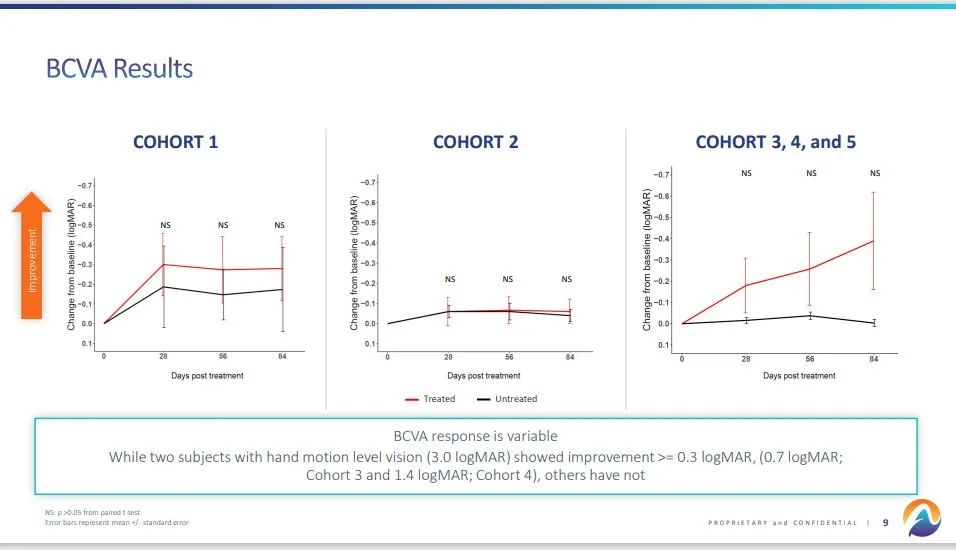
▲ATSN-101临床试验疗效结果(图片来源:参考资料[3])
安全性方面,没有报告与药物相关的严重不良事件,大多数治疗中出现的不良事件是轻微和短暂的。
ATSN-101(SAR439483)是Atsena所开发针对GUCY2D双等位基因突变引起的Leber先天性黑蒙(LCA1)患者的在研基因疗法。LCA1是一种由GUCY2D基因突变引起的单基因眼病,会破坏视网膜的功能,导致早期和严重的视力障碍或失明。目前尚无批准的LCA1治疗方法。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..