将国家卫生产品监管机构掌握的临床数据纳入系统综述进行二次分析,有助于消除发表性偏倚(publication bias)和选择性报告结果(selective outcome reporting)的影响,进而支持在开具药物、生物制品和疫苗处方时所做出的更多循证决策。近几年,加拿大卫生部根据法律的变化已开始通过“临床信息公开发布”(Public Release of Clinical Information,PRCI) 在线数据库公开临床数据信息。2023 年 10 月 28 日,收录于 BMJ journals 一篇题为“How to use the regulatory data from Health Canada for secondary analyses on new drugs, biologics and vaccines”的文章中,指导了如何访问和使用加拿大卫生部 PRCI 在线数据库获取监管数据,以便对药物、生物制品和疫苗进行二次分析。
二次分析的数据来源
系统综述和试验再分析等二次分析通常使用公开报道的数据,尤其是期刊出版物。然而,期刊出版物往往信息有限,且有发表性偏倚和选择性报告结果的影响。直接查看未发表的数据可以说是完全克服发表性偏倚的唯一方法。在这种环境下,卫生监管机构成为二次分析的重要数据来源,如美国 FDA 的 Drugs@FDA 数据库,欧盟 EMA、日本 PMDA 以及加拿大 HC 等机构公开的监管档案。尽管现在可以从这些监管机构获取大量的数据,但是研究人员很少使用,这可能源于数据获取十分复杂,且获取的报告可能长达数千页,需要研究人员投入大量的时间和精力。然而,通过指导可以缓解这些障碍。此外,监管机构和期刊之间也缺乏沟通,导致某些研究数据在被监管机构发现研究不当行为和数据不可靠时,期刊上的信息没有被及时指正。
总之,二次分析可以借助监管数据库获得更多、更可靠的数据。加拿大 PRCI 数据库相对具有明显优势:首先,加拿大公布的不仅是已获批准的产品,还包括被拒绝上市的产品;其次,加拿大允许任何人无需注册即可下载数据;第三,除了药品和疫苗,加拿大还包含医疗器械的数据。
表 1 加拿大、欧洲、美国和日本监管机构发布的监管数据的特点*
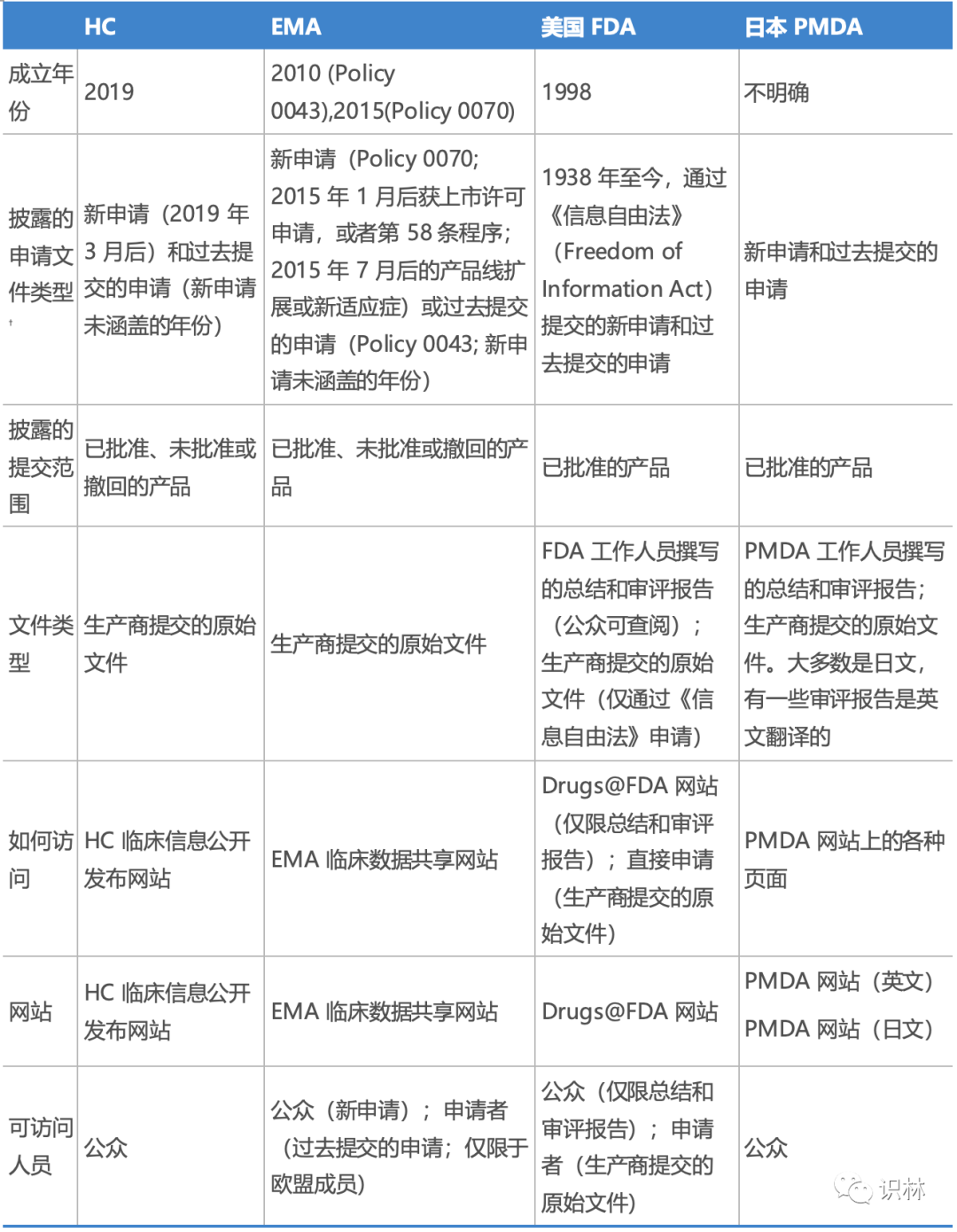
*数据来源:除了搜索监管网站之外,还参考了Egilman等人的研究。
†新申请指的是在数据库成立之后进入市场的提交,旧申请指的是在数据库启动前就已经存在的材料。(编辑注:此处考虑原文有误,以下为原文供参考:†New submissions refer to ones that enter the market prior to the inception of the databases, whereas old submissions refer to ones that are available before the launch of the databases.)
PRCI 数据库资料特点
通过对 HC PRCI 数据库的全面审查,确定了 2019 年 3 月至 2022 年 3 月期间其公开发布的 203 个与药物和生物制品(不包括医疗器械)有关的临床信息包,并根据这些临床信息包的特点进行了分类(表 2)。
表2 2019 年 3 月至 2022 年 3 月期间发布的 203 个临床资料包特点
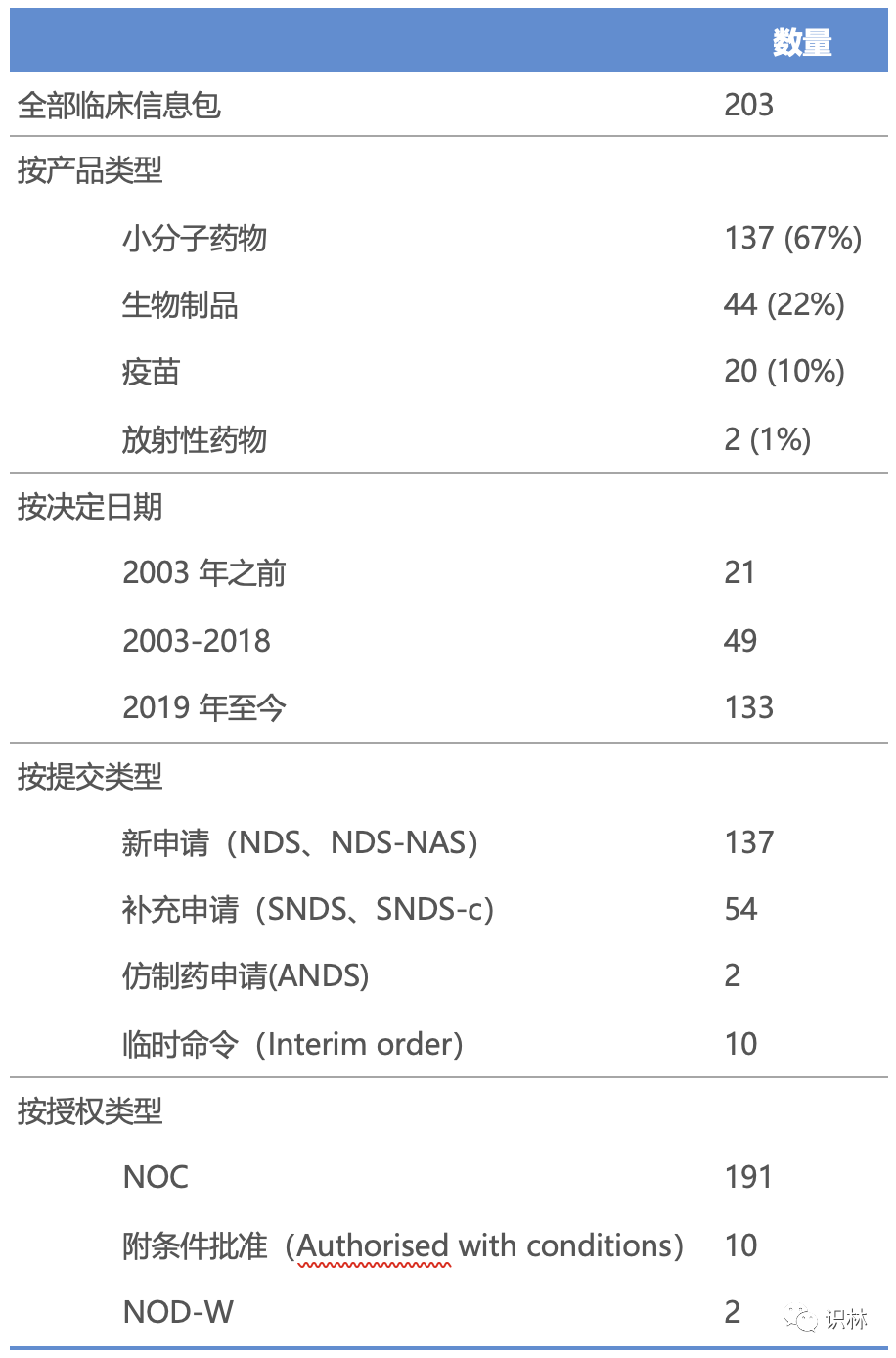
ANDS, 简约新药申请(abbreviated new drug submission); NDS, 新药申请(new drug submission); NDS-NAS, 新药申请-新活性物质(new drug submission-new active substance); NOC, 批准通知(notice of compliance); NOD-W, 缺陷撤回通知(notice of deficiency-withdrawal); SNDS, 新药补充申请(supplement to a new drug submission); SNDS-c, 包含确证性试验的新药补充申请(supplement to a new drug submission containing confirmatory trials).
PRCI 数据库包含哪些内容?
表 3 列出了 PRCI 数据库上发布的典型文件清单,这意味着获批、被拒和撤销的产品都有大量的临床数据可以被大家获取。每个临床信息包一般包含三类主要文件:临床概述、临床总结和临床研究报告(Clinical Study Report,CSR)。尤其是 CSR 对二次分析研究很有用,相对于已发表的文献中相应的研究,它们往往能够提供有关药物安全性和疗效的更准确、完整的信息。
表3 加拿大卫生部临床信息公开发布数据库中发布的常见临床信息列表
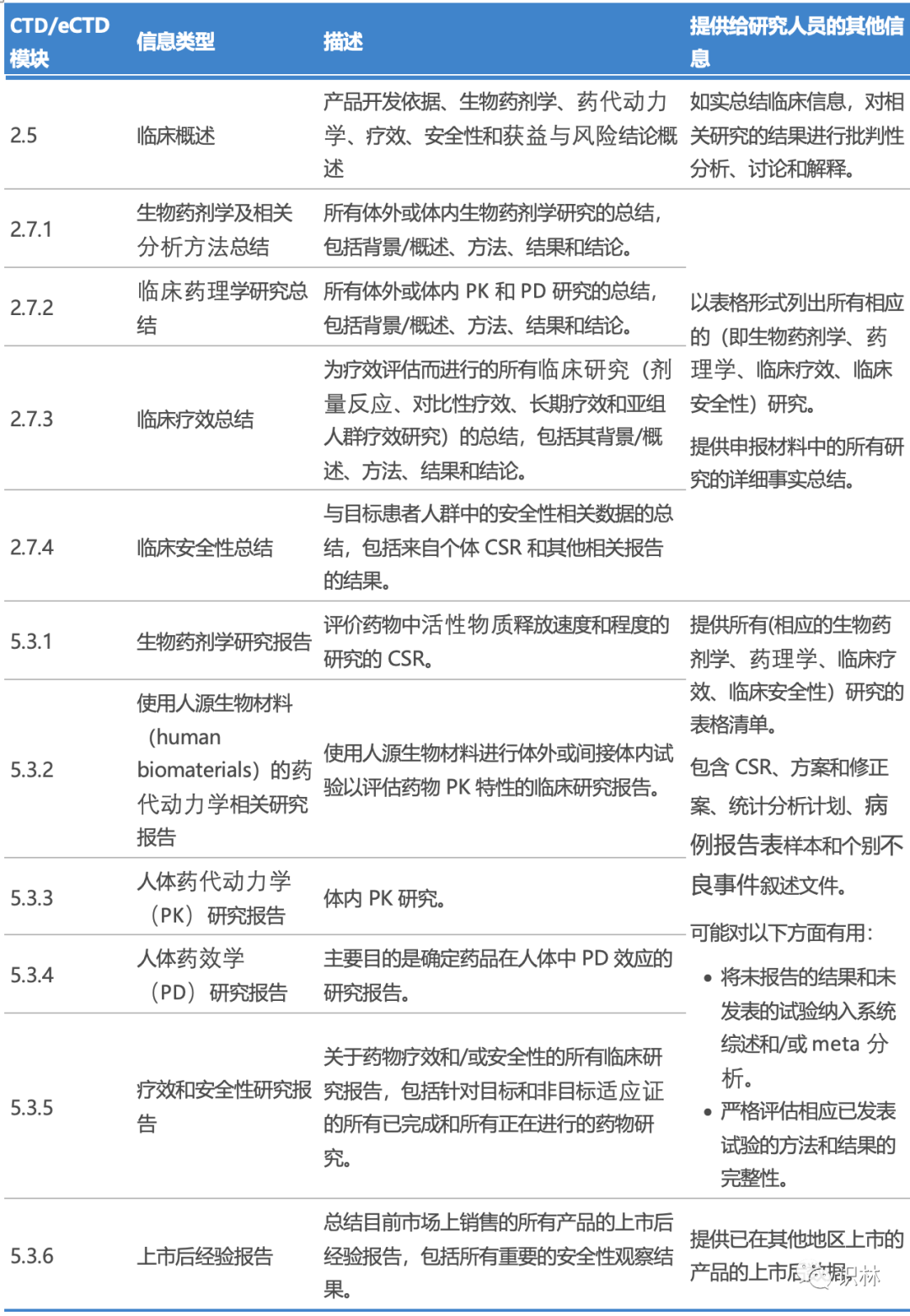
CSR, 临床研究报告(Clinical Study Report); CTD, 通用技术文件(Common Technical Document); eCTD, 电子通用技术文件(Electronic Common Technical Document); PD, 药效学(pharmacodynamic); PK,药代动力学(pharmacokinetics).
哪些信息可以用于二次分析?
由于 HC 临床信息包可能包含多个数千页的 PDF 文件,因此必须找到与二次分析目的相关的信息。
对于寻找疗效和安全性数据信息的研究人员,“临床疗效总结”和“临床安全性总结”提供了提交给 HC 以供营销决策的所有临床研究,且无论该研究是否已在生物医学文献中发表。
对于单项研究,包括其报告机构、方案和修正案以及统计方法,数据可以在 CSR 中(一般在“疗效和安全性研究报告”)中找到。
关于生物药剂学和分析方法,数据可以在“生物药剂学和相关分析方法总结”和“生物药剂学研究报告”中找到。
关于药理学信息,可以在“临床药理学研究总结”、“使用人源生物材料的药代动力学相关研究报告”、“人体药代动力学(PK)研究报告”、“人体药效学(PD)研究报告”中找到相关数据,这两部分可能与大多数寻找临床疗效和安全性数据的研究人员无关。
生物药剂学模块可能包含药物相互作用数据,药理学模块可能包含初始耐受性数据,这两个模块都可以用于补充药物安全性评估。生物制品和疫苗的免疫反应数据可以在药理学模块中找到。
无论您要查找什么类型的数据,“多个研究的综合数据分析报告”报告和“其他临床研究报告”可能包含其他模块中未找到的相关信息,包括但不限于非关键试验数据、针对不同人群的试验数据或针对不同适应症的试验数据。
如何访问数据库?
在 HC 网站上访问和下载临床信息包:
1. 首先访问加拿大卫生部临床信息公开发布网站:clinical information
2. 可以直接从列表或通过搜索访问。商品名或通用名都可以用于搜索,也可以使用过滤器缩小搜索范围。
3. 单一药物可能会有多个搜索结果,每个搜索结果都代表向 HC 申请上市批准的单独提交或适应症,都用唯一的“submission control number”表示。
4. 在数据包内,每个链接代表一个可以下载的单独 PDF 文件,也可以打包一次性下载所有 PDF。
主要挑战
虽然 PRCI 数据库包含的监管数据可以供研究人员自由访问,但是其使用率似乎不高。鉴于其数量和优势不断增加,必须提高人们对 PRCI 网站的认识。同时,由于监管机构越来越依赖于批准后的证据,该网站的价值(包含药物开发上市前阶段的证据)可能会受到限制。PRCI 数据库中包含的数据需要随着证据的发展而更新和/或与 HC 持有的其他信息来源相连接,以确保研究人员访问数据时所包含的数据是完整的、最新的。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..