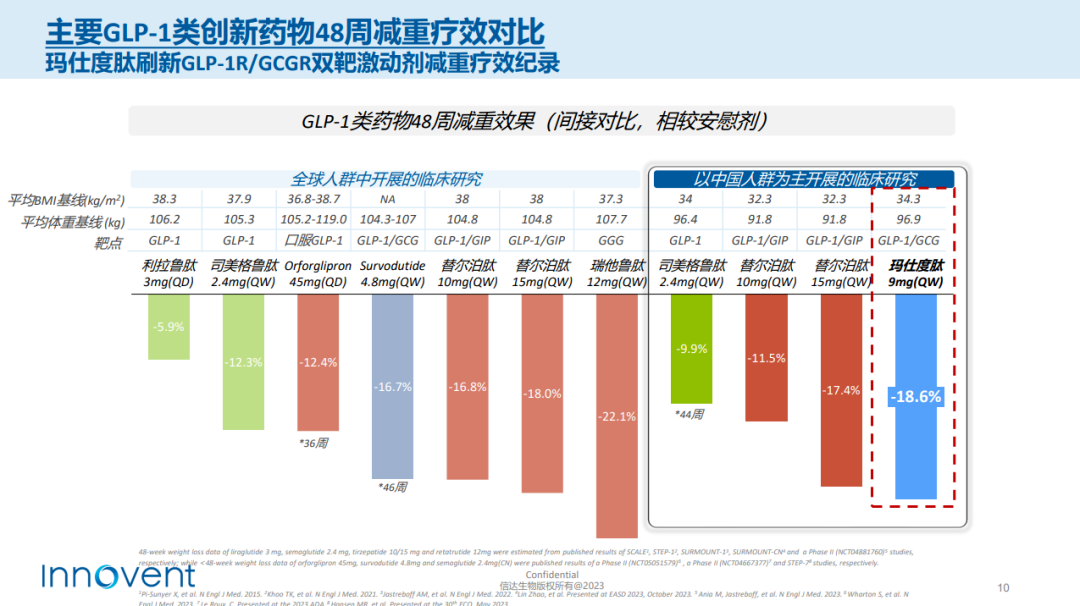
日前,信达生物公布了其与礼来共同推进的胰高血糖素样肽-1受体(GLP-1R)/胰高血糖素受体(GCGR)双重激动剂玛仕度肽(IBI362)在中国肥胖受试者中的最新II期临床数据,结果显示,相较于安慰剂组,9mg高剂量玛仕度肽治疗48周减重18.6%(约35.6斤)。
48周减重35.6斤
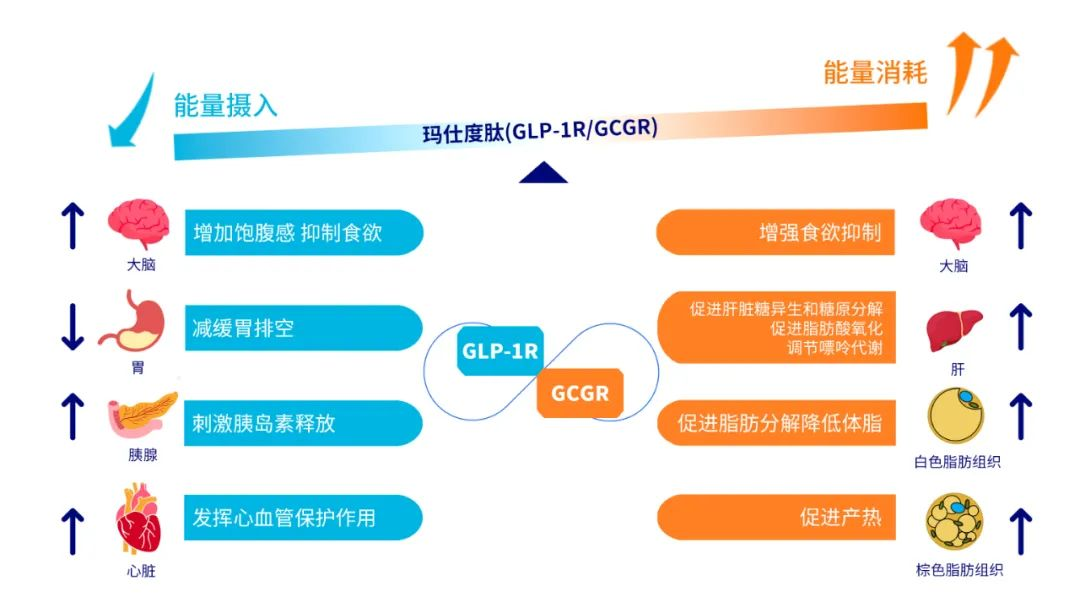
玛仕度肽属于GLP-1R/GCGR双激动剂,可通过激动GLP-1R促进胰岛素分泌、降血糖和减重,还可通过激动GCGR增加能量消耗增强减重效果并改善肝脏脂肪代谢。同时,作为一种与哺乳动物胃泌酸调节素类似的长效合成肽,玛仕度肽利用脂肪酰基侧链延长作用时间,允许每周给药一次。
此次公布的2期临床试验是一项在中国肥胖试验者(BMI≥30.0kg/m²)中评估9mg高剂量玛仕度肽疗效和安全性的随机、双盲、安慰剂对照的研究。该试验共纳入了80例试验者(平均BMI 34.3kg/m²,基线平均体重96.9kg、平均身高168.0cm),按3:1的比例随机分配到9mg玛仕度肽组和安慰剂组,接受每周一次治疗至24周。研究主要终点为治疗24周后,对比安慰剂试验者体重相对基线的百分比变化。此外,该研究还继续开展了额外24周双盲扩展治疗并延长至48周。
2023年5月,该研究主要终点达成。结果显示,治疗24周后玛仕度肽9 mg组体重较基线的平均百分比变化与安慰剂组的治疗差值达−15.4%,分别有31.7%和21.7%的受试者体重较基线下降至少15%和20%。在达到24周主要终点后,59例受试者(玛仕度肽组43/60例,安慰剂组16/20例;整体平均基线BMI 34.7 kg/m2,平均基线体重98.4 kg)同意继续接受24周研究药物双盲延长期治疗。
治疗48周后,玛仕度肽9 mg组体重较基线的平均百分比变化与安慰剂组的治疗差值达−18.6%,平均变化值与安慰剂组的差值达−17.8 kg;玛仕度肽9 mg组中51.2%的受试者体重较基线下降15%以上,34.9%的受试者体重较基线下降20%以上。与体重变化相对应,48周治疗期间玛仕度肽9 mg组受试者的腰围和血压等指标持续下降。安全性方面,玛仕度肽组在48周治疗期内无受试者因不良事件终止治疗,未发生严重不良事件。
目前,玛仕度肽4 mg和6 mg在中国超重或肥胖(GLORY-1)受试者和2型糖尿病(DREAMS-1和DREAMS-2)受试者中的三项III期注册研究正在进行中;玛仕度肽9 mg在中国肥胖受试者的III期临床研究计划于2023年底启动。信达生物预将在今年底至明年初递交6mg剂量版本减重适应症上市申请,2024年递交2型糖尿病的上市申请。
多靶点药物竞争火热
近年来,GLP-1受体激动剂因其在降低血糖的同时还可以通过抑制食欲来降低体重、实现减重,正在成为减重药研发的主流方向,而这其中,GLP-1R多靶激动剂正在成为一个热门的竞争方向。
目前,全球多靶点激动剂大多集中在GLP-1R/GIPR、GLP-1R/GCGR领域。GIPR是一种与胰岛素相关的G蛋白偶联受体,与GLP-1R具有相似的生物学功能。因此,GLP-1R/GIPR的双靶点激动剂可以提高胰岛素分泌、抑制胰岛素分泌不足等作用,从而改善治疗效果。
GLP-1R/GIPR领域主要由礼来的Tirzepatide领衔,该药的3期临床试验SURMOUNT-3数据显示,在72周的双盲治疗期间,Tirzepatide达到了疗效评估和治疗评估的共同主要终点,接受Tirzepatide治疗的患者体重平均减轻了21.1%,在次要终点中,在84周(72+12周的强化生活方式干预期),接受Tirzepatide治疗的患者总平均体重减轻了26.6%(29.2公斤),而安慰剂组84周总平均减重3.8%(4.1公斤)。目前礼来已向FDA滚动提交减重适应症上市申请,预计最早将于2023年底获得FDA批准。
国内,华东医药、豪森药业、恒瑞医药等均在布局。
GLP-1R/GCGR双靶点激动剂方面,GCGR也是一种与GLP-1R相似的受体,在肝脏中通过调节糖原分解和糖异生来影响血糖水平。GLP-1R/GCGR双靶点激动剂可以同时抑制胰高血糖素的分泌和促进胰岛素的分泌,从而起到更好的降低血糖的作用。GLP-1R/GCGR领域,信达生物、勃林格殷格翰等已启动III期临床。勃林格殷格翰方面,该公司于今年8月宣布,计划开展至少三个三期注册性临床试验,以评估其创新药物Survodutide对于超重及肥胖症患者的治疗效果。该药的二期试验数据显示,在接受最高或次高剂量Survodutide的患者中,有40%的体重降低超过20%,而安慰剂组无此效果。
国内,启赋药业、国药集团、辰欣药业、信达生物、信立泰等均在布局。
此外,还有GLP-1R/GIPR/GCGR三靶点激动剂。今年5月,礼来在Clinicaltrials.gov网站上注册了其三靶点激动剂retatrutide治疗患有心血管疾病以及肥胖疾病的临床3期试验(NCT05882045),预计于2025年可完成该试验的主要研究。该药有望成为全球首个进入3期临床的GLP-1R/GIPR/GCGR激动剂。韩美制药的HM15211紧随其后,该药正在进行NASH的临床2期试验,结果显示,同安慰剂相比,12周内脂肪肝降低效果高达80%,同时肝酶减少。基于其临床试验结果,目前HM15211已获得美国FDA的快速通道认定,预计2025年完成该试验。
国内,上海民为生物、华东医药旗下道尔生物均在布局。
认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..学习传达中央八项规定精神专题会议
2025年4月22日,协会党支部组织召..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..