药物制剂在临床使用过程中,可能需要复溶、稀释,也可能药液会与用药器具直接接触,或者多剂量包装产品需要反复开启使用,或者药物制剂会与其他药剂配伍使用。考虑药物制剂在复溶稀释后的稳定性、与给药器具的兼容性、多剂量开启后稳定性、配伍稳定性,这些稳定性研究可统称为药物制剂的使用稳定性。
配伍稳定性,是使用稳定性中的一种。2023年10月7日,CDE发布《化学药品注射剂配伍稳定性药学研究技术指导原则(征求意见稿)》,在此之前,国内外相关法规/指导原则虽然要求开展使用稳定性或配伍稳定性,但未明确具体技术要求。
以下汇总了国内外法规/指导原则中对使用稳定性(含配伍稳定性)的要求:
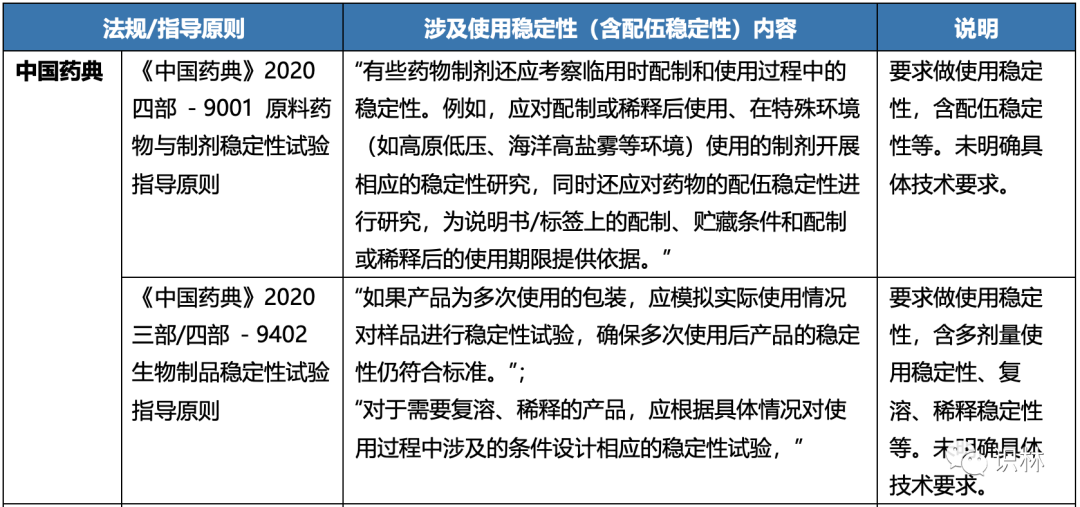
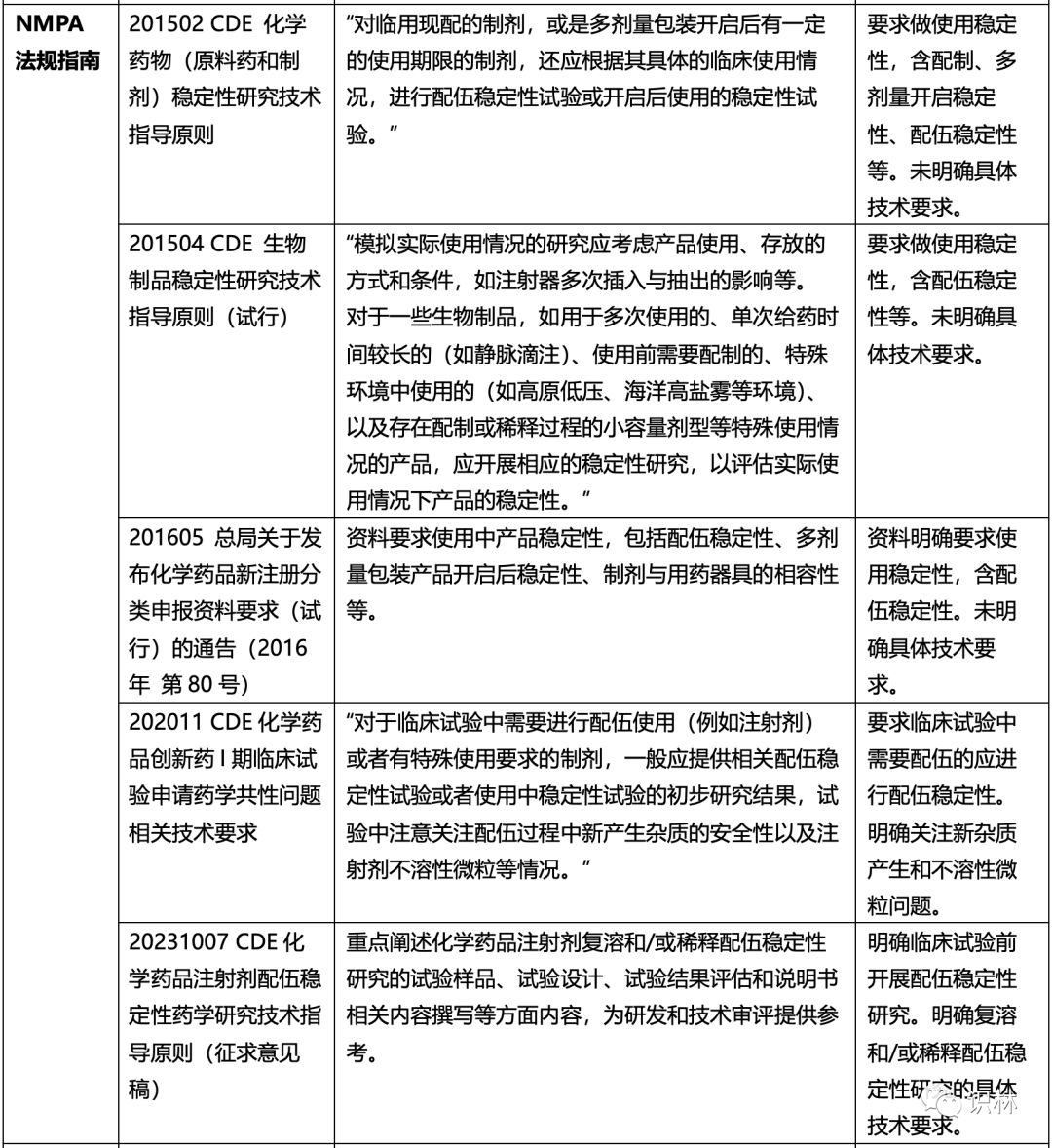

注:以上表格中,涉及使用稳定性或配伍稳定性内容中加引号内容为法规/指导原则原文。
以上可知,CDE配伍稳定性研究指导原则出来之前,对配伍稳定性研究的技术要求无明确规定,但在药品注册申报资料中,对于在临床试验中需要配制、稀释或者与其他注射剂配伍使用的药品,一般要求在临床开始前完成并提供相关研究结果,以支持临床研究的开展。《化学药品注射剂配伍稳定性药学研究技术指导原则(征求意见稿)》,可以为使用稳定性提供指导和借鉴。
以下简述文中要点和关注点提示:
原文:“根据药品特性与临床使用情况开展配伍稳定性研究。上市注册申报配伍稳定性试验的样品应具有代表性,并涵盖新生产样品和近效期样品。”
提示:IND申请前就要完成配伍稳定性研究,以提供充分的研究数据支持临床试验。在上市注册申报时,需要评估研究样品的代表性,必要时使用具有代表性的样品重新开展配伍稳定性,并应考虑分别使用新生产样品和近效期样品。
原文:“新药配伍稳定性研究应至少包括两个批次的样品,并涵盖新生产样品和近效期样品;对于稳定性差的药品,近效期样品建议采用三批,必要时可提供加速试验末期样品配伍稳定性研究资料。”
提示:对于稳定性差的药品,近效期样品采用3批,可根据杂质产生情况,如加速试验产生更多的杂质,采用加速试验末期样品进行配伍稳定性研究,以确认在苛刻条件下(例如产生更多杂质时)与配伍溶剂的稳定性。
原文:“选择配伍溶剂时,还需关注配伍溶剂的包材(玻璃瓶、软袋等)等对配伍稳定性的影响。”
提示:一般情况下,将药品加入到配伍溶剂的包装容器中,配伍稳定性的变化可能发生在配伍溶剂的包装容器中。但如果药品不是在配伍溶剂的包装容器中混合、注射,则应考虑药品和配伍溶剂进行混合时的容器材质对配伍稳定性的影响。此外,包材要考虑全面,除了玻璃瓶、软袋,还应该考虑静脉滴注的连接管路等对配伍稳定性的影响。
原文:“配伍稳定性试验应主要考察性状、溶液的澄清度与颜色、 pH值、不溶性微粒、可见异物、有关物质和含量等,特殊注射剂需根据制剂特性增加相关考察指标”
提示:对于配伍稳定性试验的考察指标的评价标准,部分考察指标可能不能使用原药品的质量标准,可能需要综合分析,质量标准应符合《中国药典》的相关规定,如配伍后药液为静脉给药,还需考虑应符合静脉注射液相关质量标准。
原文:“根据配伍稳定性试验结果,参照《化学药品说明书及标签药学相关信息撰写指导原则(试行)》相关要求,在说明书相关章节明确药品临床使用的配制方法、配伍后放置条件和允许时限”
提示:配伍稳定性结论需写入药品说明书。
作者:识林向导@Jenni-Lei
关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..