时隔5年,国家卫健委终于发布了《第二批罕见病目录》,至此,中国目前共有207种罕见病写入目录。这对企业和患者来说,无疑是个好消息,但同时也引发了业内更深层次的反思。写进目录,就能解决企业回报和患者用药问题了吗?
01
中国2000万罕见病患者规模
据统计,全球目前有 7000 多种罕见病,其中近80%为单基因遗传病,仅5%左右存在有效治疗方法。在美国,罕见病患者规模达2500~3000万,欧盟也是3000万,中国只有2000多万。
其实,全球并没有统一的针对罕见病的定义。世界卫生组织将罕见病定义为患病人数小于总人口0.65‰至1‰的疾病,美国将罕见病定义为患病人口小于20万或患病人数占总人口比例小于1/1500的疾病,而欧盟则将其定义为患病率低于1/2000的疾病。按照中国第一批罕见病目录的病种来测算,当时中国的罕见病人群更少,只有大概300多万。
中国第一批罕见病目录于2018年发布,当时中国还没有明确的罕见病定义。直至2021年《中国罕见病定义研究报告2021》出台后,国内才将罕见病明确定义为:新生儿发病率小于1/10000、患病率小于1/10000、患病人数小于14万的疾病。有业内人士表示,基于中国庞大的人口基数,这一规模依然显得不够。
有人提出,中国目前已知的罕见病数量大约有1400余种,而中国只将207种写进目录,会不会太少了?
其实,一个罕见病患者能准确用药,取决于能否被正确诊断,有没有特效药,医生是否了解特效药,以及患者是否买得起几个因素。中国只将207种罕见病写进目录,某种程度上意味着能尽快确诊这207种已经是要努力的目标,就更不用说是否有药可用,以及用不用得起了。
02
罕见病研发企业的爱恨交加
过去几年,随着国内医药监管改革,新药进入中国的速度越来越快。针对罕见病药等特殊药品,药监局也制定了一系列诸如豁免临床、加快审批等优化政策。据统计,2018年,我国批准的罕见病药物只有5款,到2019年9款,2020~2023年已经有50多款治疗罕见病的药物得到了批准。不仅是进口罕见病药快速进入中国,也有本土企业在加速引进和自研,扩充本土的罕见病管线。而且,部分罕见病药品还获得了进口减税的优惠政策。
然而对于罕见病企业来说,罕见病药的研发,患者少、研发投入高、回报漫长且有限,整体对于企业研发生产和申报的积极性造成很多困难。
2016年起,国内启动了医保谈判,对一些新药、特药展开降价谈判,同时加快医保目录调整频率,以期将更多新药特药纳入医保,减轻患者用药负担。截至目前,已有73种药物纳入医保, 涉及31种罕见病(图1)。国家医保之外,企业们也在探索共付、共创的创新模式,比如补充医疗保险(专项基金、大病保险、医疗救助等)、普惠型补充商业健康保险、民间慈善捐助等,以最大程度减轻患者的治疗经济负担。尤其针对高值罕见病用药,建立多层级支付保障体系是关键,而这实则需要社会多方的力量。
图1. 罕见病药上市及医保情况
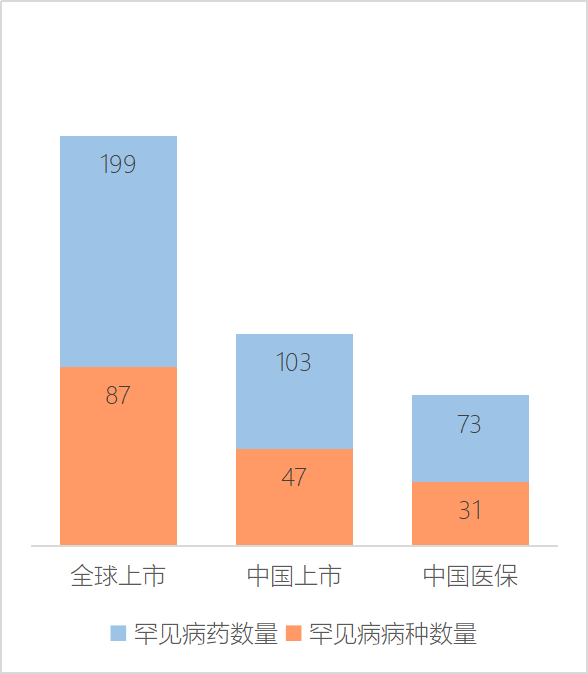
来源:2023中国罕见病行业趋势观察报告
03
医保报销后的罕见病药困局
谈判进入医保有个不成文的规定:50不谈,30不进。即年治疗费超过50万元的(按最高剂量计算)无法通过医保谈判形式审查,年治疗费超过30万元的无法通过最终的医保谈判。这也就限定了,再昂贵的药品,如果要获得医保报销,封顶线就是30万/年。因此进入中国国家医保的罕见病药,大多是治疗肺动脉高压、血友病、多发性硬化、法布雷病等相对低值的罕见病药。而高值罕见病药目前无法获得医保报销。
尽管全球罕见病市场会以年复合增长率40%的速度增至2025年的30亿美元,在中国只靠国家医保单一支付体系的支撑恐怕无法达到全球的增长规模。
以不久前要退出中国市场的唯铭赞为例:该药由Biomarin研发销售,是中国乃至全球唯一一个用于治疗罕见病黏多糖贮积症IVA型(MPS IVA)的药物。唯铭赞定价7500元/支,以25斤体重计年治疗费达200万元。2021年唯铭赞医保谈判失败,并未能获得报销资格,2022年未参与医保谈判。截至2023年6月1日,唯铭赞在13个省不同惠民保中获得覆盖。在与省医保局和患者赠药政策中,唯铭赞定价50万元左右。据相关患者组织统计,登记在案的该病患者约100多例,但目前国内用药的病人只有十几例。根据2022年前三季度的销售数据,唯铭赞在中国广阔市场(包括医院和零售等全渠道)销售额仅60余万元。公司表示:“复杂的市场准入规则使得药物的供应不可持续,特别是在罕见病治疗方面。尽管我们在过去几年中尽了最大努力,仍然没有促使唯铭赞进入医保报销体系,我们决定不再续签该产品的进口药品注册证。”该药注册证将于2024年5月到期。
目前罕见病目录的作用在于,针对目录中疾病开发的罕见病药品,才能享受罕见病药相关的审批加速政策,最终才能以罕见病药的资格进入医保。这也是之前第二批罕见病目录呼声很高的直接原因。
换言之,问题的根源不在于罕见病药在不在相关目录中,而在于整个市场的支付能力。否则就算一些罕见病药拥有所谓的7年市场独占期,也依然得不到预期的回报。
因为没有足够的回报,企业受到研发能力、资金支持上的限制,就又陷入了同质化竞争的怪圈。据业内人士统计,以第一批121个罕见病来看,在中国共有180个分子在进行开发。其中170个针对境内已经有药的,8个针对全球罕见病,只有2个是针对境外有药境内无药的。
04
罕见病的未来,如何可期
在一些发达国家和地区,认定的罕见病药物可百分之百报销。正如业内人士所说,真正的目录是不该有目录,而是对真正的少数群体的认定。而这种认定的程度,最终取决于整个国家的支付能力。国家的富裕程度,决定了能把多大范围的少数人群权利当成基本人权来维护。
根据此前发布的2023年国家医保目录调整文件,在2025年将对符合简易续约的药品销售额上限整体进行15%的上调,届时,一些药品的定价可能会放松一些限制,更多的新药特药将有望获得更符合企业和市场预期的回报。
认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..学习传达中央八项规定精神专题会议
2025年4月22日,协会党支部组织召..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..