近年来细胞治疗产品在国内发展较快,相关企业在研发和申报中出现的问题也越来越多,CDE也相继发布了针对不同学科的指导原则。其中,2017年发布的《细胞治疗产品研究与评价技术指导原则(试行)》(以下简称细胞治疗产品指导原则)中对细胞治疗产品的非临床研究做出了相应的技术要求。该指导原则未区分干细胞和免疫细胞,但两者存在细胞特性差异,使得各项研究会存在一定差别。CDE相继发布了《人源性干细胞产品药学研究与评价技术指导原则》和《人源性干细胞及其衍生细胞治疗产品临床试验技术指导原则(试行)》,此次发布的《人源干细胞产品非临床研究技术指导原则(征求意见稿)》针对干细胞产品的非临床研究策略进行了更详细的规范和指导。
文件简介
该征求意见稿的主体结构共有三部分:概述、总体考虑、基本内容。
1. 概述描述了适用范围为人源干细胞产品是指起源于人的成体干细胞(adult stem cells,ASCs)、人胚干细胞(embryonic stem cells , ESCs ) 和诱导多能干细胞(induced pluripotent stem cells,iPSCs),经过一系列涉及干细胞的体外操作,一般包括扩增、基因修饰、诱导分化、转(分)化等,获得的干细胞及其衍生细胞产品。
2. 总体考虑重申了干细胞产品的非临床研究要具体问题具体分析、符合GLP等基本原则,和制定非临床研究策略时的重要关注点,与细胞治疗产品指导原则中提出的关注点对比如下

本次征求意见稿在细胞治疗产品指导原则的基础上,提出了整合试验。即可以基于干细胞产品特点、相关动物/动物模型的可获得性,将某些非临床试验整合在其他试验中。例如将药代动力学试验整合到药效学试验和/或毒理学试验中。这一指导可能节省企业非临床研究的成本和时间。
3. 基本内容是本征求意见稿中的核心部分,整体上介绍了干细胞治疗产品要进行的非临床研究的内容。
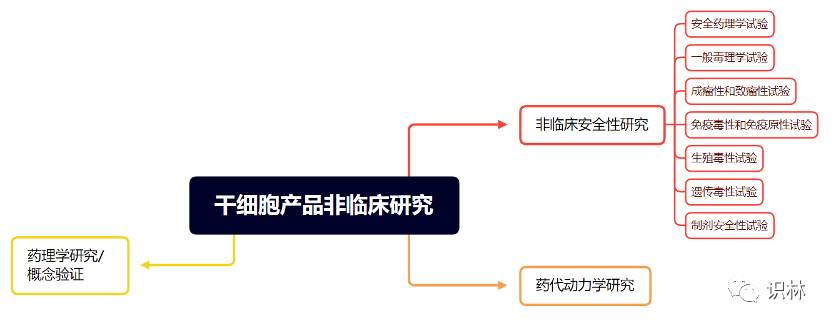
而由于干细胞产品较免疫细胞产品突出的风险在于其更高的致癌性,因此指导原则着重描述了对此类产品的一般毒理学试验、成瘤性和致瘤性试验的要求和建议。
在一般毒理学试验小节,征求意见稿给出了四个毒理学研究设计要包括的内容,即动物种属选择、分组和剂量设计、给药方案、检测指标 。而此部分内容在FDA的《Guidance of Industry: Preclinical Assessment of Investigational Cellular and Gene Therapy Products》也有相似描述。有两点差异可以借鉴:
(1)在FDA指南中明确“适当随机分配到每组的每种性别的足够数量的动物”。而干细胞产品指导原则(征求意见稿)在动物种属选择中只是要求“通常要用雌雄两种性别动物进行试验”,还未涉及到不同性别组的动物数量的原则。
(2)干细胞产品指导原则(征求意见稿)在剂量设计上更进一步地提出了“高剂量一般期望获得明显毒性反应的相关信息,通常为药效学最高剂量的一定倍数或拟推荐临床最高剂量的一定倍数。”
成瘤性和致瘤性试验是在本次的征求意见稿中较为新颖的说法。从文件内容看,成瘤性和致瘤性试验方法都是致癌性试验的部分。在文件对这两个概念的描述如下:
成瘤性(Tumorigenicity) 细胞接种动物后在注射部位和(或)转移部位由接种细胞本身形成肿瘤的可能性,即接种的细胞自身形成肿瘤的可能性。
致瘤性(Oncogenicity) 产品通过临床拟用途径给予受者(受试者/患者)后,导致受者形成肿瘤的可能性,即终产品促使正常细胞转变为肿瘤细胞的可能性。
而在EMA和FDA发布的非临床研究指南中的出现的概念均是Tumorigenicity,国内一般会翻译为致瘤性。相较于国外的指南文件,CDE的指导原则明确区分了对干细胞产品的致癌性的范围。传统都会关注干细胞产品自身形成畸胎瘤的风险即成瘤性,而容易忽视干细胞诱导其他细胞形成肿瘤的风险。
征求意见稿中成瘤性的风险因素也与FDA指南中的有一些差异,如下图所示
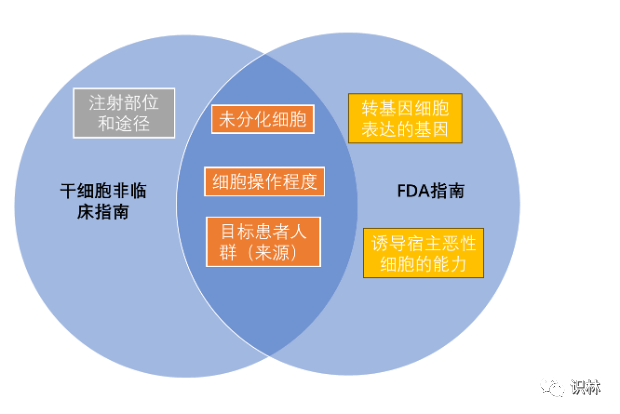
而对致癌性的非临床评价策略的要求则更为详细,并给出了一些评价成瘤性的体外试验方法的建议:核型分析(用于评估遗传稳定性)、软琼脂克隆形成试验(用于检测转化细胞)、体外细胞生长分析试验(用于评估细胞的永生化能力/程度)、数字 PCR(用于检测未分化的 iPSCs 或ESCs)等。
推荐内容
1. 对合并研究的建议
在征求意见稿中提到,安全药理学试验可结合在一般毒理学试验中;鼓励在药效学研究中伴随生物分布研究。
2. 动物源替代产品
对于行业人员在非临床研究中比较关心的用动物源替代产品代替临床拟用产品的问题,征求意见稿也出了更明确的的说明。即在当无法采用临床拟用产品进行动物试验时,可以使用,但要进行对比研究。但征求意见稿也在多处强调采用从动物源替代产品非临床试验中获得的数据进行临床转化时,存在一定的不确定性。
且在文中也同样特地指出:“成瘤性和/或致瘤性试验应采用临床拟用产品进行试验,不可采用动物源替代产品。”因此总体的意见是不可用动物源替代产品进行非临床研究。
关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..