1
Amgen非小细胞肺癌
药物Lumakras
Amgen的上市药物sotorasib(Lumakras)是一种口服靶向疗法药物,治疗患有KRAS基因G12C突变的非小细胞肺癌患者。KRAS G12C突变来自于癌症相关的基因突变,在非小细胞肺癌患者中非常常见。这种突变使KRAS蛋白质的结构发生了变化,导致癌细胞的异常增长和分裂。Sotorasib通过抑制这种突变的KRAS蛋白质活性,减缓或停止癌细胞的生长。Lumakras是FDA批准的第一个针对曾经被认为“无法成药”的突变的疗法。
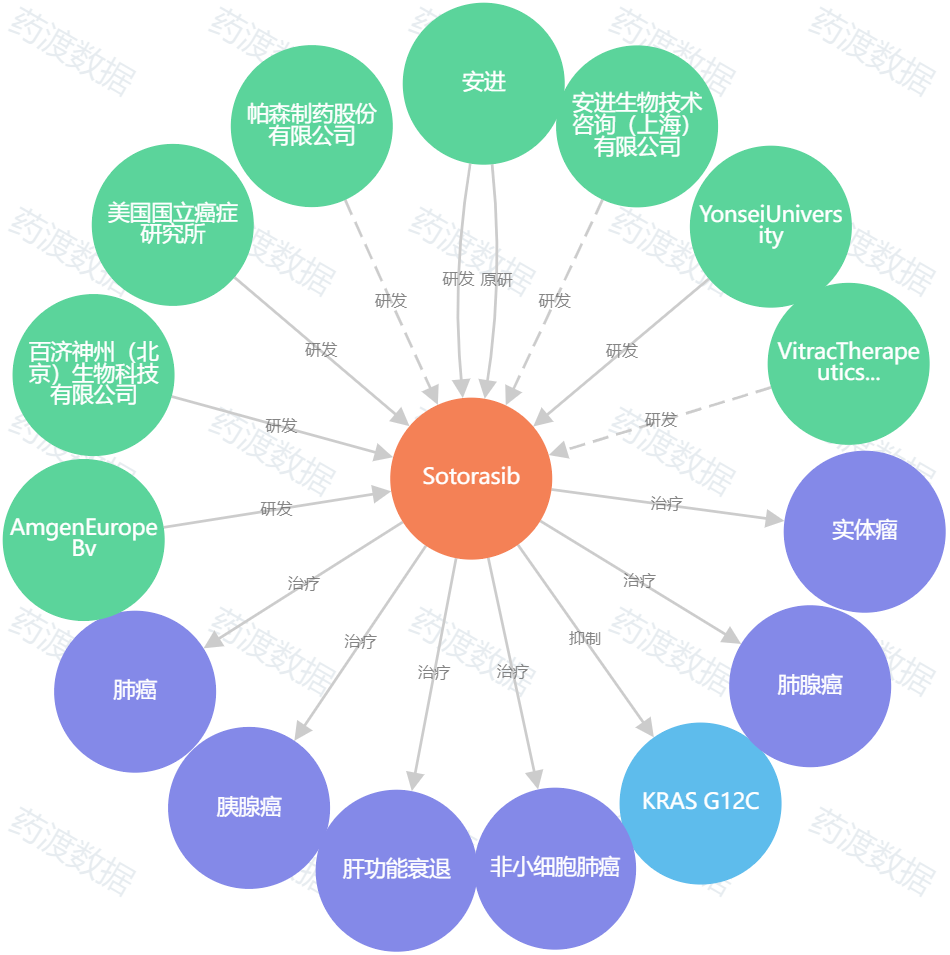
图1. sotorasib知识图谱,来源:药渡数据
2021年5月28日,sotorasib获得FDA加速批准,用于治疗患有KRAS G12C突变的非小细胞肺癌患者,这些患者之前接受过至少一种全身治疗。在sotorasib加速批准之前,首选标准护理方案为单药多西紫杉醇(docetaxel)。
2
Lumakras上市后
研究遭到FDA质疑
作为验证sotorasib临床获益的上市后研究(PMR)的一部分,Amgen进行了开放标签临床试验CodeBreaK 200。试验将患者以1:1的比例随机分配接受单药口服 sotorasib或单药静脉注射多西紫杉醇,主要终点是无进展生存期(PFS)。
10月5日,FDA肿瘤药物咨询委员会讨论把Lumakras的加速批准转变为全面批准的可能性。但在正式讨论之前,FDA发布了一份文件,表达了他们对CodeBreaK 200临床试验中的统计学“系统性偏差”(systematic bias)问题的关注。
具体来说,Amgen在临床试验中产生的统计学系统性偏差的错误,主要来自于他们的试验设计和数据分析之间的矛盾。
根据FDA的文件,CodeBreaK 200试验中,sotorasib组的无进展生存期PFS的中位数为5.6个月,而对照组多西紫杉醇的PFS中位数为4.5个月。从数据上来看,这两个组PFS中位数以及95% Cl对应的范围所给出的p-value为0.002,因此Amgen得出了主要终点已实现的结论。
FDA注意到,使用sotorasib的受试者的PFS中位数,相较于对照组高出了将近5个星期,然而这项试验的患者测试间隔,在试验的前49周为每6周测试一次,接下来每9周测试一次。对比测试间隔和PFS增益,FDA得出了试验结果分析存在系统性偏差的结论。
PFS事件(即第一次发现肿瘤生长)可以发生在两次测量之间的任何一个时间点,因此PFS的结果认定会存在高估的情况(例如第一个PFS事件发生在第六周的第一天,但只会在第12周的测量中被发现,因此PFS被认定为12周,但实际应该是6周零1天)。
尽管存在这样的偏差,但这种测量和分析方法仍然是可以接受的,因为测量中的这种预期误差应该与随机组之间相似。但具体到CodeBreaK 200试验,情况就并非这么简单了。因为两组PFS的中位数差异仅为5周,而测量间隔却达到了6周,所以测量上造成的误差相对于PFS增益来说过大,因此FDA得出了不能完全确认PFS增益来自于药物本身的结论,因为无法排除两组之间的差异不是由于测量误差所造成的。
3
试验设计与数据分析
对临床结论的重要性
针对Amgen数据分析和结论中存在的统计学漏洞,FDA对CodeBreaK 200的PFS数据使用了区间截尾(interval censoring)的方法重新进行了评估。Interval censoring是主要分析(primary analysis)的一种替代方式。它假设对于在评估间隔结束时评估为进展性疾病的任何患者,他们的PFS事件可能发生在分析间隔期间的任何时间。对于已经发生PFS事件的个体,事件所发生的时间被认为是区间的左端点。也就是说,在6周一次的检测中,如果第6周零一天的PFS事件被检测到(只能在第12周被检测到),那么这个PFS在interval censoring中将被视为6周,而不是primary censoring中的第12周。
FDA通过interval censoring方法得到的sotorasib组的中位PFS为4.2个月,而多西紫杉醇组为4.3个月。同Amgen得出的结论相反。这更加剧了FDA对于sotorasib对PFS增益结论有效性的怀疑。鉴于试验设计和分析问题,FDA担心CodeBreaK 200可能不算是一项充分且得到良好控制的试验,因此可能无法提供实质性证据来支持sotorasib有效性的主张。
Amgen在CodeBreaK 200中犯下的统计学错误,实际上可以类比于DoE(Design of Experiments)实施之前,没有提前搞清楚信噪比(signal-to-noise)就盲目开始实验的问题。
在DoE中,提前了解信噪比的意义在于帮助研究人员更好地规划和执行实验,确保实验结果的可信度和可重复性。高信噪比通常表示噪声与信号相比相对较小,噪声对结论造成的影响也较小。了解这一点,可以提高实验结果的可靠性和稳定性。如果信噪比低,那么实验结果可能受到随机误差的干扰,结果可能不稳定、难以复制。了解信噪比还有助于确定需要多大的样本,以及是否需要进行多次实验重复,以获得具有统计显著性的结果。
在Amgen的试验中,由于测量方法(过长的取样间隔)本身固有的偏差,可能会对结论的可靠性和有效性带来挑战。如果能够提前预测到这个问题,或许Amgen应该将每六个星期测量一次的间隔,缩短到每两个星期一次,而不是仅仅依靠p-value来得出结论。毕竟提高测量频率所带来的成本增加,要远远小于被FDA质疑临床试验结论所造成的可能后果。
参考资料:
FDA Brief Document. Oncologic Drugs Advisory Committee Meeting. NDA 214665 s005. Sotorisab.
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..