印度太阳制药(Sun Pharmaceutical)近日宣布,其斥资5.76亿美元收购Concert Pharmaceuticals获得的新型氘代口服JAK1/2抑制剂deuxolitinib,用于治疗中重度斑秃成年患者的新药申请(NDA)已获美国食品药品监督管理局(FDA)受理。
在NDA中,太阳制药向FDA提交的是每天两次8mg deuruxolitinib方案供其审查。
今年5月,deuxolitinib临床试验研究中发生了一起血栓事件,引发了FDA对该关键候选药物开发的部分搁置。
在deuxolitinib治疗斑秃3期试验的开放标签扩展研究中,一名患者接受了12 mg、每日两次剂量的口服deuxolitinib发生了血栓。
在得知不良事件后,FDA实施了部分临床暂停,要求太阳制药停止每天两次12毫克的给药剂量。
患者可以继续每天两次的8毫克给药,太阳制药也随即采取“立即措施”将开放标签研究的参与者转移到较低剂量。在8 mg给药剂量下,没有患者出现血栓事件。
由于在开放标签扩展之前没有血栓形成事件,太阳制药对deuxolitinib治疗斑秃的潜力仍有信心,最终提交上市申请或FDA受理。
deuxolitinib未发生肺栓塞或深静脉血栓是其3期数据的优势。去年,礼来的JAK抑制剂Olumiant治疗斑秃适应症获得FDA批准,由于安全问题,包括肺栓塞发病率增加,该药物在美国受到黑框警告。
太阳制药向FDA提交deuxolitinib的NDA申请基于两项关键的III期试验(THRIVE-AA1和THRIVEAA2),这两项试验包括135多个临床试验点的1200多名患者。在两项3期试验中,8mg剂量的deuxolitinib具有一致且高水平的疗效。早在第8周,与安慰剂相比,治疗组在实现临床意义的SALT评分≤20方面就出现了显著差异,并在整个研究中保持了这种差异。与安慰剂相比,deuxolitinib的治疗总体上耐受性良好,8mg剂量的患者满意度显著更高。
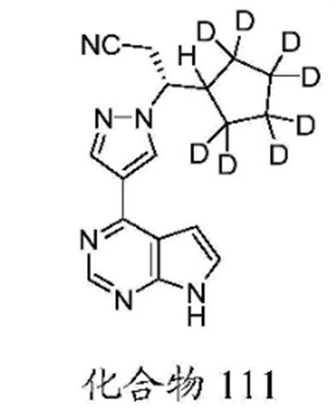
deuxolitinib化合物专利已在国内授权(CN104725380B),专利保护期到2033年底。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..