美国FDA发布了对SOPP 8402的第9版修订。该SOPP的标题为重大增补的指定(Designation of Amendments as Major),即FDA在审评时确定增补申请是否为重大增补的相关政策和程序。(Standard Operating Policy and Procedure (SOPP), 是CBER工作人员在履行职责时使用的标准操作政策和程序。)
SOPP 8402中的与增补有关的政策和程序只适用于受《处方药使用者付费法案》(PDUFA)监管的BLA和NDA及相关的补充申请,也包含生物类似药(BsUFA)。但不适用于ANDA,以及受《医疗器械使用者付费法案》监管的BLA。
修订内容
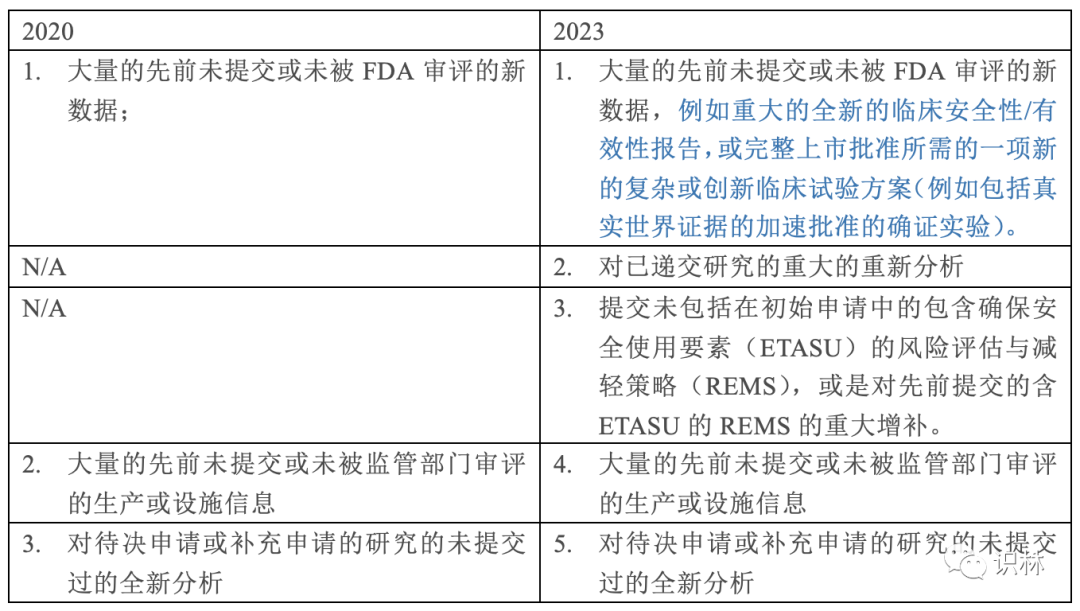
本次发布的版本较2020年发布的版本比,内容没有太大变化,仅是在政策(第V章节)部分增加了少量内容。具体为在E小节的可以被认定为重大增补的情形增加二种,并对第一种情形做了内容补充:
修订影响
重大增补的情形范围的扩大意味着:申请人提交的增补若是属于那三种,如今可能会被CBER认定为重大增补。而在审评周期的任意时间提交重大增补会使得审评时钟(review clock) 得到延长:
对于初始申请和有效性补充申请:目标日期将延后3个月。
对于生产补充申请:目标日期将延后2个月。
而根据21 CFR 314.60,非重大增补不会延长审评周期的时限,FDA可自行决定在初始周期审评该增补或推迟至下一个审评周期。
如今重大增补范围的明确扩大对企业是利还是弊不能一概而论。从时间进度考虑,在向FDA申报注册时应该要尽可能避免增补被认定为重大,这样会拖延产品的批准日期。因此企业在注册前就应当尽量做好各项工作,尤其要关注此次SOPP新规定的提交REMS。
关于重大增补
在21 CFR 314.60有对增补的详细规定。根据该SOPP,CBER只允许在每个审评周期提交一项重大增补。
重大增补由CBER收到增补后判定,具体流程如下图所示
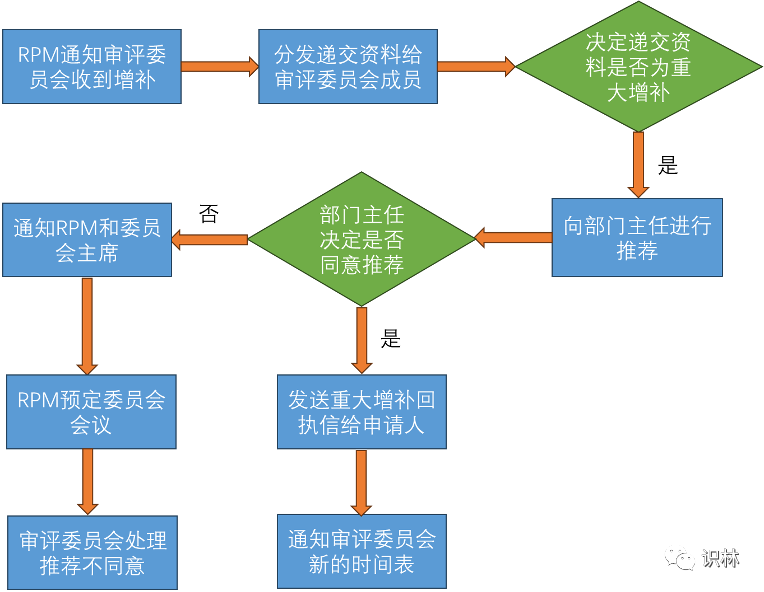
其中,委员会成员决定是否递交资料是否为重大增补的时限为14个自然日。而部门主任同意认定重大增补后,RPM会在7天内起草回执信并发送申请人。回执信会告知申请人该增补已被接受为重大增补,并通知新的审评期限。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..