Neurocrine Biosciences公司公布了3期CAHtalyst儿科研究的积极顶线数据,分析显示其在研疗法crinecerfont达成主要终点以及关键次要终点。在因21-羟化酶缺乏(21-OHD)导致的经典先天性肾上腺皮质增生症(CAH)儿童和青少年中,其体内血清雄烯二酮(androstenedione)较基线统计学显著降低。Neurocrine预计于2024年递交相关数据给美国FDA与欧洲药品管理局(EMA)。

先天性肾上腺增生症是指一组遗传性代谢疾病,患者缺乏促进肾上腺激素生产的酶。大约95%的CAH病例是由导致21-羟化酶缺乏的突变引起的。在典型的CAH中,这种酶的严重缺乏会导致肾上腺不能产生皮质醇,在大约75%的病例中,会导致醛固酮缺乏。如果不及时治疗,典型的CAH可导致患者盐耗、脱水,甚至死亡。糖皮质激素是该疾病的标准疗法,目前尚无获美国FDA批准用于治疗经典CAH的非糖皮质激素药物。
Crinecerfont是一种在研口服、选择性促肾上腺皮质激素释放因子1型受体(CRF1)拮抗剂,通过激素非依赖性机制减少和控制过量的肾上腺雄激素,用于治疗因21-羟化酶缺乏症导致的先天性肾上腺增生。研究显示,拮抗脑垂体中的CRF1可降低促肾上腺皮质激素水平,进而减少肾上腺雄激素的生成,并可能减少与经典CAH相关的症状。
CAHtalyst全球性3期试验旨在评估crinecerfont在21-OHD所致的CAH儿童和青少年(2-17岁)中的安全性、疗效和耐受性,共入组了103例女性和男性CAH患者。试验包括28周随机双盲、安慰剂对照期,以及随后24周开放标签治疗和开放标签扩展期。研究于2021年7月开始,开放标签治疗部分仍在进行中。
分析显示,该3期儿科研究达到主要终点,表明在糖皮质激素(GC)稳定后,与安慰剂相比,crinecerfont治疗使得患者在第4周时的血清雄烯二酮较基线统计学显著降低(p=0.0002)。
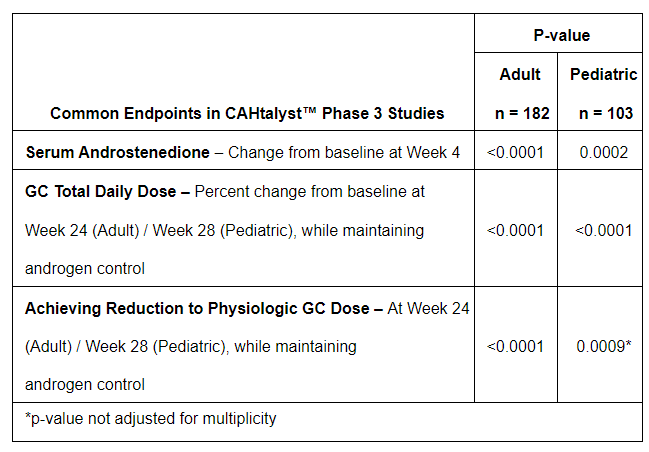
▲3期CAHtalyst儿科研究疗效结果(图片来源:参考资料[1])
重要的是,此结果与3期CAHtalyst成人研究的结果一致。在第28周时,与安慰剂相比,crinecerfont治疗使得患者在维持雄激素控制的同时,其每日所需糖皮质激素剂量百分比的降低具统计学显著性(p<0.0001)。约30%接受crinecerfont治疗的受试者在维持雄激素控制的同时达到了生理GC剂量的降低,而接受安慰剂治疗的受试者为0%。
Crinecerfont通常耐受良好。在试验的双盲、安慰剂对照期间,最常见的不良事件是头痛、发热、呕吐、上呼吸道感染和鼻咽炎。严重不良事件很少,无事件被评估为与crinecerfont相关。
参考资料:
[1] Neurocrine Biosciences Announces Phase 3 Pediatric Study Results of Crinecerfont in Children and Adolescents for the Treatment of Congenital Adrenal Hyperplasia Met Primary and Key Secondary Endpoints. Retrieved October 5, 2023 from https://neurocrine.gcs-web.com/news-releases/news-release-details/neurocrine-biosciences-announces-phase-3-pediatric-study-results
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..