事件:9月20日,国家卫健委等六部门联合制定了《第二批罕见病目录》,纳入包括软骨发育不全、获得性血友病等86种罕见病。目前我国共有207种罕见病纳入目录,但罕见病用药两大痛点仍难以获得有效解决,罕见病群体用药需求远未获得满足。
第一大痛点:挑战国产企业创新能力,供给严重缺乏
2000万罕见病患者“无药可用”
全世界发现的罕见病超过7000种,约80%为遗传性疾病,90%的罕见病没有特效的诊疗方法,仅仅约有5%具备有效治疗的药物。我国人口基数大,各类罕见病患者占比虽小,但绝对数已达2000多万。在药品供给方面,由于罕见病市场需求小、研发难度大、研发成本高、周期长,我国罕见病药物的研发仍处在初期阶段,99%的罕见病无有效治疗药物,因此治疗罕见病的药物又称为“孤儿药”。
对比美国FDA近几年获批上市的罕见病药物数量,仅2020-2022年三年,获批上市的数量就已达到87种(图)。截止2022年底,在我国获批上市的罕见病药物一共仅有75种,与国家公布的两批罕见病目录总数(第一批:121种,第二种:86种)相比,国内已上市药物数量严重不足。罕见病药物的研发难度大,2018年-2022年,我国共27种罕见病药物上市(新增适应症除外),仅有4种药物为国内企业引进或仿制,罕见病研发对国产企业的创新能力提出了极大挑战。供给严重缺乏的背景下,2000多万罕见病患者面临“无药可用”的困境,用药需求难以得到满足。
图:美国FDA历年获批孤儿药数量(种)
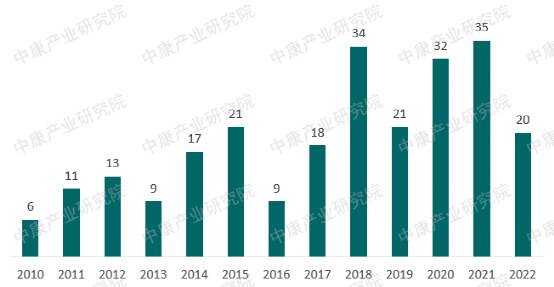
数据来源:公开资料,中康产业研究院整理
第二大痛点:用药负担高昂
系统性罕见病用药保障机制亟待建立
除了“无药可用”外,少部分有药可用的罕见病“幸运儿”还面临另一大困境:用药费用高昂。当前,医保基金是罕见病用药保障的主要承担主体。自国家医保局成立以来,已累计有20多种罕见病用药纳入医保目录,药价平均降价超50%,大大减轻了患者用药负担。
在2021年国家医保目录调整中,曾经每针70万元的天价救命药——治疗脊髓性肌萎缩症的诺西那生钠注射液经医保谈判后,以3万余元被纳入医保。2022年医保目录中,新增药品涵盖7个罕见病用药,分别为:利司扑兰口服溶液用散、富马酸二甲酯肠溶胶囊、拉那利尤单抗注射液、奥法妥木单抗注射液、伊奈利珠单抗注射液、曲前列尼尔注射液、利鲁唑口服混悬液。
除国家医保外,罕见病患者还可通过补充医疗保险(专项基金、大病保险、医疗救助等)、普惠型补充商业健康保险、民间慈善捐助等途径减轻治疗的经济负担。考虑到医保覆盖范围有限,补充途径报销比例有限、实现难度大等问题,系统性的罕见病用药保障机制亟待建立。
研发、审批、用药保障全线推进
罕见病用药发展前景向好
罕见病用药痛点的解决难度大,但相关基础建设仍在持续推进。
在研发技术指导方面,针对罕见病单病种的发病率极低特点,罕见病药物研究难度远远超过其他常见多发病。针对这一特殊性,国家药监局对治疗罕见病创新药给予特殊政策倾斜,制定了一系列技术指导原则,如《罕见疾病药物临床研发技术指导原则》、《罕见疾病临床研究统计学指导原则》等。今年7月,国家药监局药审中心又发布《罕见疾病药物开发中疾病自然史研究指导原则》,继续为罕见病药物开发提供指导。
针对审评审批流程,国家药监局为罕见病药物建立了专门通道,在审评审批环节,对包括罕见病用药在内的境外临床急需新药单独排队,鼓励申报,加快审评。根据这个政策,据统计有23个罕见病新药通过专门通道获批上市,到2022年明确进一步深化改革,明确优先审评程序,将具有明显临床价值的罕见病新药纳入优先审评审批程序,目前在所有的药品申请上市当中,罕见病新药的审评审批时限是最短的。
在用药保障建设上,2023年国家医保药品目录调整工作方案中对罕见病用药的申报条件未设置上市时间限制,纳入国家鼓励仿制药品目录的药品可以申报当年医保目录,进一步拓宽了罕见病用药的准入范围。目前,我国正着手于建立罕见病用药供应监测机制、提高罕见病用药研发和产业化水平等一系列举措,努力提高罕见病用药保障水平。
近年来,国家陆续出台两批罕见病目录,组建了全国罕见病诊疗协作网,成立了中国罕见病联盟,为罕见病行业发展创造环境。未来,罕见病治疗还将从治疗方式上进行改善,如多学科会诊、精准诊疗、中医药参与罕见病防治等,从疾病治疗角度为罕见病患者提供更多解决方案。
认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..学习传达中央八项规定精神专题会议
2025年4月22日,协会党支部组织召..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..