9 月 22 日,NMPA 最新批件显示,赛诺菲「度普利尤单抗」新适应症获批上市(受理号:JXSS2300021),用于治疗成人结节性痒疹。
这项上市申请此前在今年 2 月 22 日被 CDE 纳入优先审评,3 月 7 日获正式受理,今日获批上市。
度普利尤单抗此前已在国内获批 4 项适应症,首次上市批准时间为 2020 年 6 月,用于治疗成人中重度特应性皮炎,随后,又陆续申报两项适应症,分别针对 12 岁及以上的中重度特应性皮炎患者,以及 6~12 岁的中重度特应性皮炎患者,均以儿童用药的理由纳入优先审评审批并取得批准,今年 5 月又将获批年龄拓展至 6 个月至 5 岁。
度普利尤单抗国内获批适应症

截图来自:Insight 数据库网页版(http://db.dxy.cn/)
度普利尤单抗(Dupilumab)是赛诺菲与再生元合作开发的一款人源性单克隆抗体,靶向 IL-4Rα。通过结合 IL-4Rα,度普利尤单抗可同时阻断 IL-4 和 IL-13 信号通路,IL-4 和 IL-13 被认为是特应性皮炎持续性炎症的主要驱动因子。
2017 年 3 月,度普利尤单抗获 FDA 批准成为首个用于治疗成人中重度特应性皮炎的靶向生物药,商品名为 Dupixent®,上市首年即实现销售额 2.51 亿美元。此后,Dupixent 又先后获批了哮喘、鼻息肉适应症,2019 年其全球销售额为 23.13 亿美元,涨幅高达 150%;到 2022 年其销售额仍然维持着高涨幅,达到 87.31 亿美元年销售额,在全球药品销售额 TOP 榜上稳坐前列,又连续获批结节性痒疹、婴幼儿特应性皮炎以及嗜酸性食管炎适应症,且还在拓展其他适应症,市场前景可观。
度普利尤单抗全球销售额
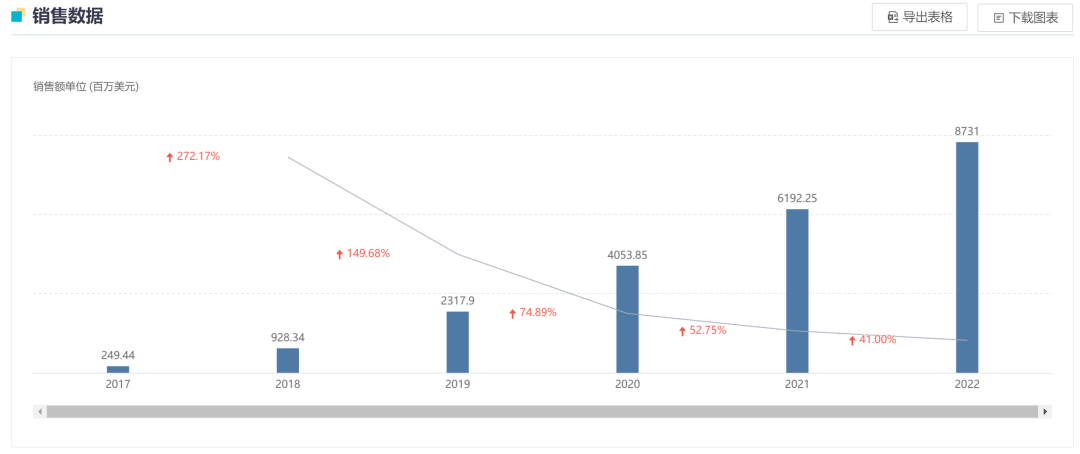
截图来自:Insight 数据库网页版,下同
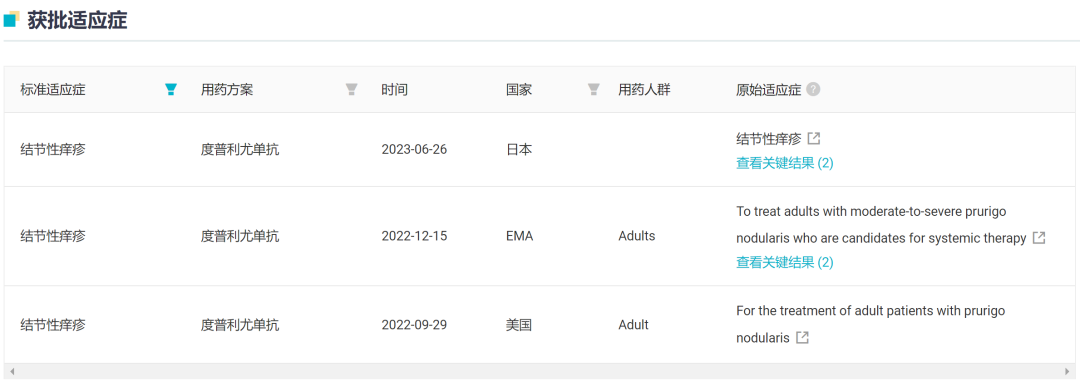
针对结节性痒疹,已在去年 9 月、12 月和今年 6 月分别在美国、EMA、日本获批上市,也是全球首款专门用于治疗结节性痒疹的药物。
结节性痒疹适应症获批地区
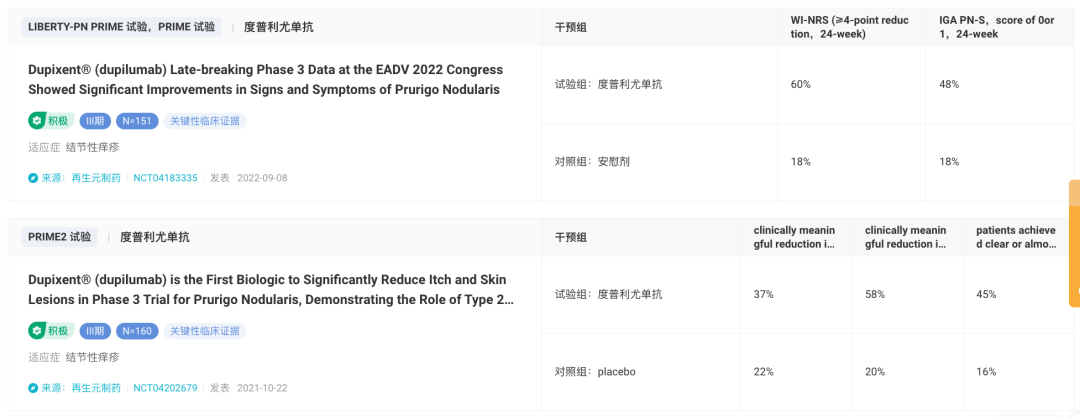
该适应症的顺利获批是基于两项随机、双盲、安慰剂对照的 III 期临床PRIME2、PRIME 试验。该两项研究分别在 160 例和 151 例结节性痒疹成人患者中,评估了度普利尤单抗(Dupixent)的疗效和安全性。
PRIME2 研究结果显示,达到主要终点方面:治疗第 12 周时,度普利尤单抗治疗组有 37% 的患者瘙痒程度较极鲜检查时有临床意义的减轻,而安慰剂组为 22%(p=0.0216)。同时,也达到了关键次要终点:在治疗第 24 周时,度普利尤单抗治疗组瘙痒较基线有临床意义减轻的患者比例是安慰剂组的 3 倍(58% vs 20%,p<0.0001);此外,度普利尤单抗治疗组皮损达到完全清除或几乎完全清除的患者比例是安慰剂组的 3 倍(45% vs 16%)。
PRIME 研究结果则显示:在治疗 24 周时,度普利尤单抗治疗组中有 60% 患者瘙痒程度较基线检查时有临床意义的减轻,而安慰剂组为 18%(p<0.0001)。此外,度普利尤单抗治疗组中 48% 患者皮损达到完全清除或几乎完全清除,而安慰剂组为 18%(p=0.0004)。
在安全性方面,与度普利尤单抗在已批准的其他皮肤病适应症中的已知安全性特征基本一致,常见不良反应为结膜炎。
结节性痒疹临床结果
认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..学习传达中央八项规定精神专题会议
2025年4月22日,协会党支部组织召..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..