9月15日,GSK宣布FDA已批准Ojjaara(momelotinib)上市,用于治疗中度或高风险骨髓纤维化,包括原发性骨髓纤维化或继发性骨髓纤维化(真性红细胞增多症和原发性血小板增多症)成人贫血患者。Ojjaara是首个也是唯一适用于骨髓纤维化合并贫血患者的治疗方法。

Momelotinib是一种具有差异化作用机制的靶向JAK1、JAK2与ALK2的新药,通过抑制JAK1和JAK2可改善全身症状和脾肿大。与其他JAK抑制剂不同的是,momelotinib还可以抑制ALK2,铁调素在骨髓纤维化中过度表达会导致贫血,momelotinib能够改善炎症性贫血,就是因为该药能抑制肝脏ALK2介导的铁调素表达,动员细胞内的铁进入血液,从而刺激红细胞生成,进而改善骨髓纤维化相关的贫血。
Momelotinib最先由Sierra Oncology开发,2022年7月GSK以约19亿美元的价格收购该公司并获得这款产品。
此次获批上市是基于关键III期MOMENTUM研究的积极结果以及来自III期SIMPLIFY-1试验的成年贫血患者亚群。
MOMENTUM研究是一项随机、双盲的全球III期临床试验,旨在评估momelotinib治疗和减少疾病关键特征的安全性和有效性,包括症状、输血(由于贫血)和脾肿大。该试验纳入195例有症状和贫血以及既往接受过JAK抑制剂治疗的患者,按2:1随机分为莫莫替尼组(n=130)或达那唑组(n=65)。
该研究的主要终点是,根据骨髓纤维化症状评估表,在第24周结束前的28天内,TSS较基线降低≥50%。关键的次要终点包括第24周结束前≥12周的TI率,血红蛋白水平≥8g/dL,以及第24周时脾容量较基线减少≥35%的SRR。
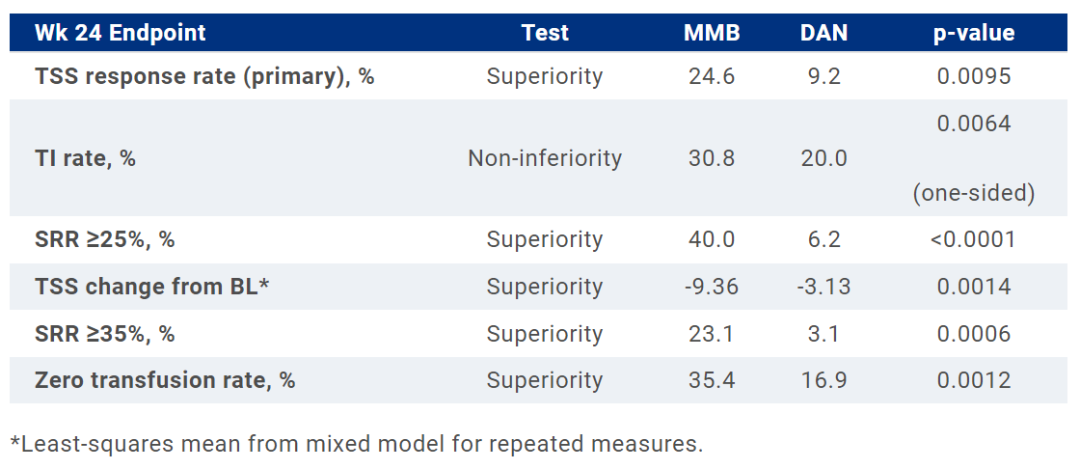
结果显示,该试验已达到主要终点和关键次要终点,包括总症状评分(TSS)、输血独立性(TI)率和脾脏反应率(SRR)。具体来看,莫莫替尼 vs 对照组达到TSS≥50%患者比例为25% vs 9%(p=0.0095),不依赖输血:31% vs 20%(p=0.0064,非劣效性),SRR≥35%:23% vs 3%(p=0.0006)。
骨髓纤维化是一种罕见的血癌,由失调的JAK信号转导途径和转录蛋白信号激活剂引起,症状表现为全身症状、脾明显肿大和进行性贫血。在美国,骨髓纤维化影响着约2万例患者,其中约40%患者在诊断时已经贫血,几乎所有患者最终都会发展为贫血。目前批准的JAK抑制剂只能解决全身症状和脾肿大,并且具有骨髓抑制作用,易导致贫血恶化,若为此减少剂量,那么治疗效果将会大打折扣。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..