刚刚,GSK宣布美国FDA批准其JAK抑制剂Ojjaara(momelotinib)用于治疗中度或高风险骨髓纤维化,包括原发性骨髓纤维化或继发性骨髓纤维化(真性红细胞增多症后和原发性血小板增多症后)成人贫血患者。根据新闻稿,Ojjaara是首个获批用于新确诊和经治、患有贫血的骨髓纤维化患者的药物,减缓该疾病的关键症状,即贫血和脾脏肿大等。
骨髓纤维化是一种罕见的血液癌症,由JAK-STAT信号传导失调所致,以全身症状、脾脏肿大和进行性贫血为特征。之前的研究表明,约一半的骨髓纤维化患者在符合JAK抑制剂治疗条件时存在中度至重度贫血。然而,目前获批的JAK抑制剂仅能改善症状和脾肿大,并会导致骨髓抑制。这可能引起贫血恶化,导致需要降低药物剂量,因此降低治疗效果。
Ojjaara具有独特的作用机制,可抑制三条关键信号通路:激活素A受体I型(ACVR1)、JAK1和JAK2。Sierra Oncology于去年6月向美国FDA递交该药物治疗骨髓纤维化的新药申请(NDA)。在去年7月,GSK宣布完成对Sierra Oncology公司的收购。获得这款在研疗法的开发权益。
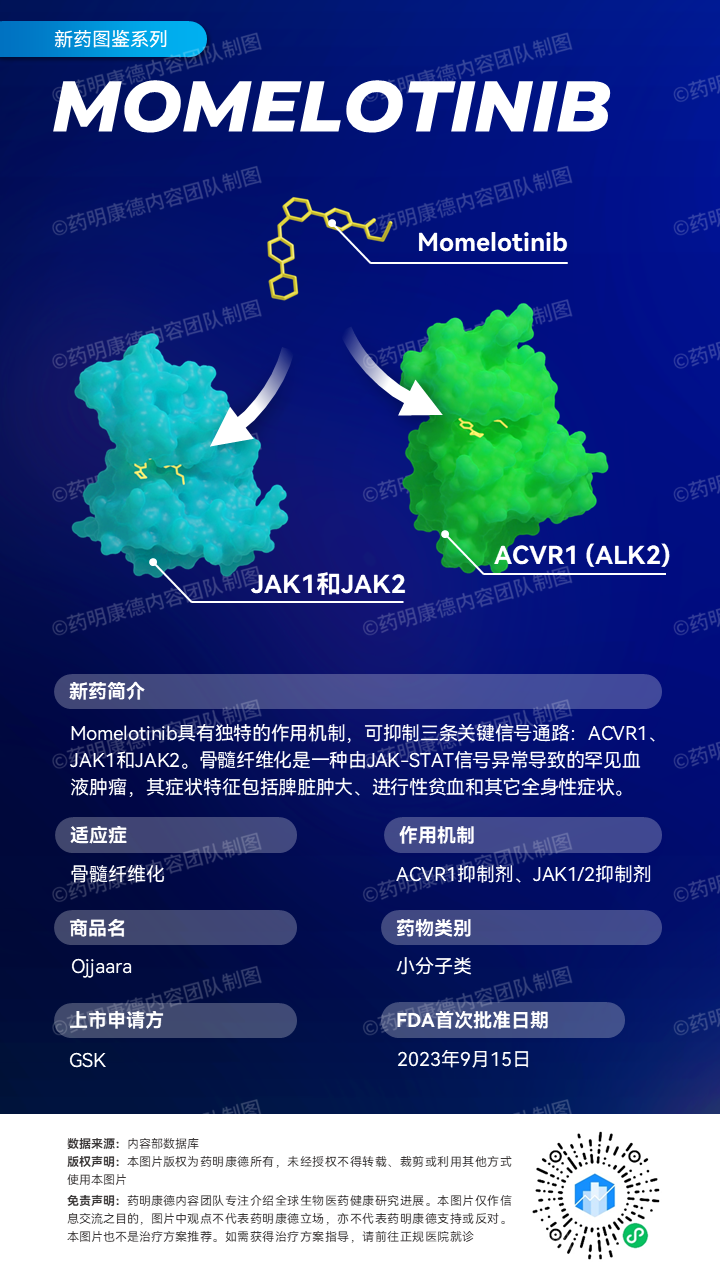
这次美国FDA的批准主要基于关键性临床3期试验MOMENTUM的数据和SIMPLIFY-1临床3期试验中成人贫血患者亚群的数据。MOMENTUM试验旨在评估在经JAK抑制剂治疗、患有贫血并有临床症状的骨髓纤维化患者中,Ojjaara与达那唑(danazol)相比的疗效与安全性。分析显示,Ojjaara达到所有主要和关键次要终点。治疗24周时,Ojjaara组达到总体症状评分(TSS)较基线改善超过50%的患者比例为25%,对照组这一数值为9%。24周时不依赖输血的患者比例:Ojjaara组为31%,对照组为20%;脾脏体积减少超过35%的患者比例:Ojjaara组为23%,对照组为3%。这表明Ojjaara在缓解症状、脾脏应答和控制贫血方面较对照组具有统计学显著性的改善,且这一改善具有临床价值。
在这些临床试验中,最常见的不良反应为血小板减少、出血、细菌感染、疲乏、头晕、腹泻和恶心。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..