1
三款仿药相继获批
近日,正大天晴的沙库巴曲缬沙坦钠片获国家药监局批准上市,这是国内第3款获批的沙库巴曲缬沙坦仿制药。

图1. 正大天晴沙库巴曲缬沙坦钠片获批,来源:CDE官网
8月24日,南京方生和医药宣布,其子公司南京一心和医药公司研发的沙库巴曲缬沙坦钠片(商品名:一心坦)获NMPA批准上市。这是我国首家申报的沙库巴曲缬沙坦钠片仿制药,也是全球法规市场首个通过自主创新突破原研专利壁垒成功获批上市的该品种药物。

图2. 一心坦获批上市,来源:方生和医药官微
同一日,石药集团也宣布,其子公司石药欧意开发的沙库巴曲缬沙坦钠片(50mg、100mg、200mg)获得了NMPA批准上市。

图3. 石药欧意沙库巴曲缬沙坦钠片获批,来源:CDE官网
2
销售额“进击”的诺欣妥
诺华新药中的重磅炸弹
沙库巴曲缬沙坦钠片(商品名:Entresto),是诺华公司研发的一款血管紧张素受体脑啡肽酶抑制剂(ARNI)类药物,于2015年获得FDA批准上市,是全球首款心衰和高血压治疗领域的突破性创新药。2017年,Entresto获批进入中国市场,商品名为“诺欣妥”,用于治疗心衰,后被纳入2020年国家医保目录。2021年6月,诺欣妥在国内获批用于原发性高血压治疗适应症。并且在2021年的国谈中,诺欣妥成功续约,并新增原发性高血压适应症。
自上市以来,Entresto的销售额一直快速增长。2018年,销售额便突破了10亿美元大关,随后以超过35%的平均同比增速一路上涨。2022年,全球销售额达到46.44亿美元,同比增长37%,在诺华的管线里仅次于可善挺(司库奇尤单抗)的47.88亿美元,排名第二。2023年上半年,Entresto销售额为29.15亿美元,同比增长31%,全年有望突破60亿美元。Entresto已然成长为诺华近年来开发的新药中「重磅炸弹」级别。
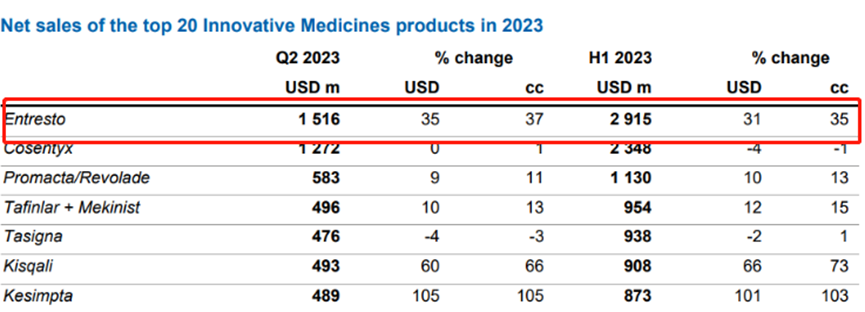
图4. Entresto 2023上半年销售数据,来源:诺华2023H1财报
在国内市场,诺欣妥同样表现出色。数据显示,2021年,其院内销售额一举突破20亿元,同比增长177%;2023年第一季度,诺欣妥院内销售额为6.5亿元,总销售额还将进一步提升。
3
市场潜力十足
国内超20家药企布局“抢食”
沙库巴曲缬沙坦钠巨大的市场潜力,自然会吸引诸多仿制药企。截至今年8月底,CDE共承办了39品规关于沙库巴曲缬沙坦钠片的上市申请,覆盖药企20余家,除方生和、石药欧意、正大天晴外,还有科伦、倍特、齐鲁等明星药企。
表1. 已报产沙库巴曲缬沙坦钠片药企,来源:CDE官网


值得注意的是,Entresto的两项核心专利(ZL200680001733.0、ZL201210191052.2)至2026年11月8日才到期,国内获批的仿制药要想早日上市销售,免不了需要面对专利挑战。事实上,由于Entresto并非新分子,而是一种由沙库巴曲和缬沙坦钠形成的分子复合物,因此,从2018年以来,关于Entresto的专利挑战就一波接一波。
4
绕不开的“专利战”
沙库巴曲缬沙坦钠之所以引起行业的极大关注,除了巨大的市场潜力外,还因其在固态技术领域的开创性。
从分子结构上看,Entresto的药物活性成分LCZ696是由沙库巴曲与缬沙坦按照1:1摩尔比例结合而成的盐复合物晶体,每个药物分子含有2.5个结晶水。LCZ696的独特性之一在于它是一个具有特定化学和晶体结构的超分子复合物。将两种有效的药物成分结合在同一晶胞内,使得它们可以在体内同时释放。在犬体内,口服LCZ696片剂后,缬沙坦的暴露量是同时分别口服沙库巴曲片剂与缬沙坦片剂后的3倍。人口服LCZ696片剂后,与缬沙坦单药相比,LCZ696给药后的缬沙坦暴露量提高40%。LCZ696与沙库巴曲/缬沙坦的物理混合物相比,其生物利用度明显提高。

图5. 诺欣妥的分子式,来源:参考资料2
诺华在中国市场为诺欣妥分别申报了组合物专利(专利号:ZL201110029600.7)和晶型专利(专利号:ZL200680001733.0/ZL201210191052.2),尤其是独特的晶型专利让诺欣妥在中国市场的独占期可持续到2026年11月。
表2. 诺欣妥登记的专利,来源:中国药品专利信息登记平台

鉴于诺欣妥的成功和巨大潜力市场,上市后,其遭到了来自仿制药生产企业的多个专利挑战,诺华也频频试图通过诉讼抵御各类仿制药企业发起的专利挑战。
在2019年之前,石药欧意、齐鲁制药、北京四环制药、山东新时代药业、正大天晴、信立泰等国内药企就对诺欣妥提出了专利无效挑战,涉及到沙库巴曲缬沙坦钠片关键性的2项化合物和组合物专利。
2021年7月2日,国家知识产权局连发三份公告称,信立泰、正大天晴、石药欧意三家公司向诺欣妥发起的专利挑战,国家知识产权局认定:诺华“诺欣妥”的专利权部分无效,即组合物专利无效,晶型专利有效。
该晶型专利可以让诺欣妥在中国市场的独占期持续到2026年11月。那么,为什么国内药企的仿制药提前获批上市了?
据悉,南京方生和医药的一心坦是含有3个结晶水的新晶型,规避了原研含有2.5个结晶水的晶型专利障碍,从而实现了仿制药的合法提前上市。方生和医药宣布,一心坦将通过复星医药向全国销售。
针对仿制药的获批,诺华公司立即发布声明表示,沙库巴曲缬沙坦钠的两项专利目前均处于有效状态。

图6. 诺华声明,来自:诺华官微
业内人士表示,由于一心坦成功绕过诺欣妥的晶型专利障碍,或可提前结束诺欣妥在国内的垄断地位。而石药欧意和正大天晴尚未明确说明其仿制药是如何规避原研的晶型专利的。
5
小结
创新药和仿制药的平衡是医药产业生态维持健康的基础保障。为了在鼓励创新积极性和提高药物可及性(鼓励仿制药)之间做到平衡,健全的法律体系必不可少。2021年7月,我国颁布了《药品专利纠纷早期解决机制实施办法》,即我国的“专利链接制度”,为鼓励新药研究和促进高水平仿制药发展,使我国药品知识产权保护制度进一步与国际接轨奠定了基础。
在集采倒逼下,我国当前的仿制药企业正在从初级的价格竞争进入高阶的技术竞争阶段。对于国内仿制药企来说,通过自主研发绕开某些核心专利壁垒,抢占首仿,无疑是值得鼓励的。同时,诺华诺欣妥的专利布局也让我们明白晶型专利的重要性,值得借鉴学习。
认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..学习传达中央八项规定精神专题会议
2025年4月22日,协会党支部组织召..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..