BioLineRx今天宣布,美国FDA已批准Aphexda(motixafortide)联合filgrastim(粒细胞集落刺激因子G-CSF)动员造血干细胞至外周血,以作为多发性骨髓瘤患者在移植时促进患者自体移植的干细胞动员(SCM)。根据新闻稿,Aphexda是十年来首个在多发性骨髓瘤干细胞动员方面获得FDA批准的创新药物。
多发性骨髓瘤是第二常见的血液系统恶性肿瘤。自体干细胞移植(ASCT)是多发性骨髓瘤标准疗法的一部分,可延长该癌症类型患者的生存期。ASCT的成功取决于治疗过程中干细胞的充分动员。美国移植和细胞治疗学会(ASTCT)指南推荐的采集目标为根据患者体重,每公斤采集300-500万个CD34阳性细胞。根据统计,高达47%的患者在单次采治疗后难以收集足够用于ASCT的干细胞数量。
Aphexda是一款创新CXCR4抑制剂,通过皮下注射给药。
FDA此次批准主要是基于两部分的GENESIS临床3期试验的结果,该试验是一项随机双盲、安慰剂对照的研究,评估了Aphexda加G-CSF,相比安慰剂加G-CSF动员造血干细胞用于多发性骨髓瘤患者自体移植的安全性和有效性。第一部分是一项单中心、导入期、开放标签研究,包含12例接受Aphexda与G-CSF治疗的患者,旨在确定药物使用剂量。第二部分包含122例患者,为一项随机双盲、安慰剂对照的多中心研究。
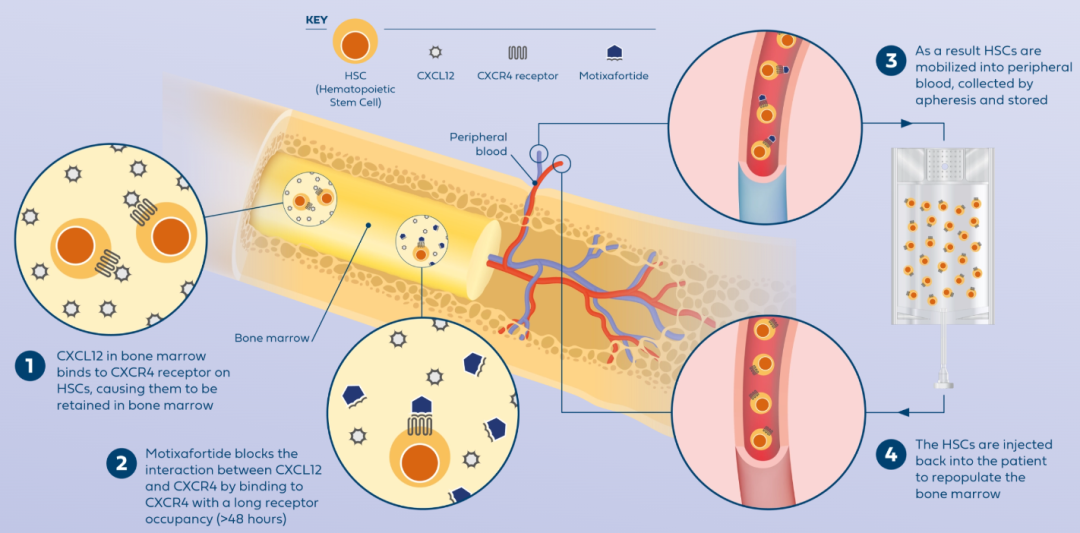
▲Aphexda促进干细胞动员(图片来源:参考资料[2])
CD34阳性细胞采集的评估同时由中央和地方实验室进行。中央实验室评估结果用于药物的有效性分析,当地实验室结果则用于评估临床治疗决策。根据中央实验室的测量结果,Aphexda加G-CSF联合方案使得67.5%的患者在两次单采治疗中达到干细胞实现采集每公斤≥600万个CD34阳性细胞的目标,而此数值在安慰剂加G-CSF方案组当中仅为9.5%。而根据当地实验室的测量,有92.5%的Aphexda组患者在最多两次单采治疗中达到干细胞采集目标,此数值在安慰剂组为21.4%。
Aphexda与G-CSF联合方案通常显示良好的耐受性以及安全性特征。GENESIS试验中最常见的不良反应(发生率>20%)是注射部位反应(疼痛、红斑和瘙痒)、瘙痒、潮红和背痛。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..